��Ŀ����
�о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ�Ŀ��⣮
��1��CO�����ںϳɼ״�����ѹǿΪ0.1Mpa�����£������ΪbL���ܱ������г���amolCO��2amolH2���ڴ��������ºϳɼ״���CO��g��+2H2��g��?CH3OH��g��ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��
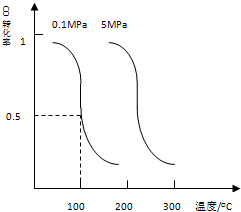
��i���÷�Ӧ����______��Ӧ��������ȡ����ȡ�����
��ii��100��ʱ���÷�Ӧ��ƽ�ⳣ����K=______������a��b�Ĵ���ʽ��ʾ������һ�����淴Ӧ��ƽ�ⳣ��Kֵ�ܴԴ˷�Ӧ��˵����ȷ���ǣ�______����ţ�
a���÷�Ӧʹ�ô������岻��
b���÷�Ӧ�������ںܶ�ʱ������ɣ�
c���÷�Ӧ�ﵽƽ��ʱ������һ�ַ�Ӧ��ٷֺ�����С��
d���÷�Ӧһ���Ƿ��ȷ�Ӧ��
��iii�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���amolCO��2amolH2���ﵽƽ��ʱCOת����______������������䡱��С������ͬ��ƽ�ⳣ����______��
��iv����ij�¶��£���һ�ݻ�������ܱ������г���2.5molCO��7.5molH2����Ӧ����CH3OH��g�����ﵽƽ��ʱ��COת����Ϊ90%����ʱ������ѹǿΪ��ʼʱ��ѹǿ______����
��2��ij�¶������£�����CO2��g����H2��g���������1��4��ϣ����ʵ�ѹǿ�ʹ��������¿��Ƶü��飬��֪��
CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.3KJ/mol
H2��g��+
O2��g��=H2O��l����H=-285.8KJ/mol
��CO2��g����H2��g����Ӧ����Һ̬ˮ���Ȼ�ѧ����ʽΪ��______��
��1��CO�����ںϳɼ״�����ѹǿΪ0.1Mpa�����£������ΪbL���ܱ������г���amolCO��2amolH2���ڴ��������ºϳɼ״���CO��g��+2H2��g��?CH3OH��g��ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��

��i���÷�Ӧ����______��Ӧ��������ȡ����ȡ�����
��ii��100��ʱ���÷�Ӧ��ƽ�ⳣ����K=______������a��b�Ĵ���ʽ��ʾ������һ�����淴Ӧ��ƽ�ⳣ��Kֵ�ܴԴ˷�Ӧ��˵����ȷ���ǣ�______����ţ�
a���÷�Ӧʹ�ô������岻��
b���÷�Ӧ�������ںܶ�ʱ������ɣ�
c���÷�Ӧ�ﵽƽ��ʱ������һ�ַ�Ӧ��ٷֺ�����С��
d���÷�Ӧһ���Ƿ��ȷ�Ӧ��
��iii�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���amolCO��2amolH2���ﵽƽ��ʱCOת����______������������䡱��С������ͬ��ƽ�ⳣ����______��
��iv����ij�¶��£���һ�ݻ�������ܱ������г���2.5molCO��7.5molH2����Ӧ����CH3OH��g�����ﵽƽ��ʱ��COת����Ϊ90%����ʱ������ѹǿΪ��ʼʱ��ѹǿ______����
��2��ij�¶������£�����CO2��g����H2��g���������1��4��ϣ����ʵ�ѹǿ�ʹ��������¿��Ƶü��飬��֪��
CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.3KJ/mol
H2��g��+
| 1 |
| 2 |
��CO2��g����H2��g����Ӧ����Һ̬ˮ���Ȼ�ѧ����ʽΪ��______��
��1����i����ͼ��֪��ѹǿһ��ʱ�����¶����ߣ�CO��ת���ʽ��ͣ��������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��ii��100�棬ƽ��ʱCO��ת����Ϊ0.5�����Բμӷ�Ӧ��CO�����ʵ���Ϊ0.5amol��
CO��g��+2H2��g��?CH3OH��g����
��ʼ��mol����a 2a0
�仯��mol����0.5a a0.5a
ƽ�⣨mol����0.5a a0.5a
����ƽ��ʱ��CO��Ũ��Ϊ
=
mol/L��H2��Ũ��Ϊ
=mol/L��CH3OH��Ũ��Ϊ
=
mol/L��100��ʱ�÷�Ӧ��ƽ�ⳣ��k�T
=
��
a�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���÷�Ӧ��ͨ��������һ�����Է������÷�Ӧ������Ҫ�����ſ��Խ��У���a����
b�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���������·�Ӧ���ʺܿ죬��b����
c�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ�Ӧ��ƽ��ʱ������һ�ַ�Ӧ��İٷֺ�����С����c��ȷ��
d�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���÷�Ӧ�����Ȼ��Ƿ��ȣ���d����
�ʴ�Ϊ��
��c��
��iii�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���amolCO��g����2amolH2��g������ЧΪ��ԭƽ��Ļ���������һ��ѹǿ��ƽ��������Ӧ�ƶ���CO��ת��������ѧƽ�ⳣ��ֻ���¶�Ӱ�죬��Ũ���أ��¶Ȳ��䣬ƽ�ⳣ�����䣬
�ʴ�Ϊ�������䣻
��iv���μӷ�Ӧ��CO�����ʵ���Ϊ2.5mol��90%=2.25mol����
CO��g��+2H2��g��?CH3OH��g�� ���ʵ������١�n
1 2
2.25mol 4.5mol
��ƽ��ʱ�ܵ����ʵ���Ϊ2.5mol+7.5mol-4.5mol=5.5mol�����º�����ѹǿ֮�ȵ������ʵ���֮�ȣ���ƽ��ʱ������ѹǿΪ��ʼʱѹǿ��
=0.55����
�ʴ�Ϊ��0.55��
��2����֪����CH4��g��+2O2��g���TCO2��g��+2H2O��l����H1=-890.3kJ?mol-1
��H2��g��+
O2��g���TH2O��l����H2=-285.8kJ?mol-1��
���ø�˹���ɣ����ڡ�4-�ٿɵã�CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=4����-285.8kJ?mol-1��-��-890.3kJ?mol-1��=-252.9kJ?mol-1��
�ʴ�Ϊ��CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=-252.9kJ?mol-1��
�ʴ�Ϊ�����ȣ�
��ii��100�棬ƽ��ʱCO��ת����Ϊ0.5�����Բμӷ�Ӧ��CO�����ʵ���Ϊ0.5amol��
CO��g��+2H2��g��?CH3OH��g����
��ʼ��mol����a 2a0
�仯��mol����0.5a a0.5a
ƽ�⣨mol����0.5a a0.5a
����ƽ��ʱ��CO��Ũ��Ϊ
| 0.5amol |
| bL |
| a |
| 2b |
| a |
| b |
| 0.5amol |
| bL |
| a |
| 2b |
| ||||
|
| b2 |
| a2 |
a�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���÷�Ӧ��ͨ��������һ�����Է������÷�Ӧ������Ҫ�����ſ��Խ��У���a����
b�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���������·�Ӧ���ʺܿ죬��b����
c�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ�Ӧ��ƽ��ʱ������һ�ַ�Ӧ��İٷֺ�����С����c��ȷ��
d�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���÷�Ӧ�����Ȼ��Ƿ��ȣ���d����
�ʴ�Ϊ��
| b2 |
| a2 |
��iii�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���amolCO��g����2amolH2��g������ЧΪ��ԭƽ��Ļ���������һ��ѹǿ��ƽ��������Ӧ�ƶ���CO��ת��������ѧƽ�ⳣ��ֻ���¶�Ӱ�죬��Ũ���أ��¶Ȳ��䣬ƽ�ⳣ�����䣬
�ʴ�Ϊ�������䣻
��iv���μӷ�Ӧ��CO�����ʵ���Ϊ2.5mol��90%=2.25mol����
CO��g��+2H2��g��?CH3OH��g�� ���ʵ������١�n
1 2
2.25mol 4.5mol
��ƽ��ʱ�ܵ����ʵ���Ϊ2.5mol+7.5mol-4.5mol=5.5mol�����º�����ѹǿ֮�ȵ������ʵ���֮�ȣ���ƽ��ʱ������ѹǿΪ��ʼʱѹǿ��
| 5��5mol |
| 2.5mol+7.5mol |
�ʴ�Ϊ��0.55��
��2����֪����CH4��g��+2O2��g���TCO2��g��+2H2O��l����H1=-890.3kJ?mol-1
��H2��g��+
| 1 |
| 2 |
���ø�˹���ɣ����ڡ�4-�ٿɵã�CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=4����-285.8kJ?mol-1��-��-890.3kJ?mol-1��=-252.9kJ?mol-1��
�ʴ�Ϊ��CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=-252.9kJ?mol-1��

��ϰ��ϵ�д�
�����Ŀ