题目内容
工业上制备合成气的工艺主要是水蒸气重整甲烷:
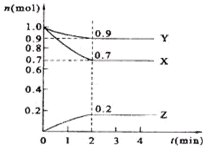
CH4(g)+H20(g)═C0(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1molCH4(g)和1molH20(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如右图所示,下列说法正确的是( )

CH4(g)+H20(g)═C0(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1molCH4(g)和1molH20(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如右图所示,下列说法正确的是( )
| A.达平衡时,CH4(g)的转化率为75% |
| B.O-10min内,v(CO)=0.075mol?L-1.min-1 |
| C.该反应的化学平衡常数K=O.1875mol?L-1 |
| D.当CH4(g)的消耗速率与H20(g)的生成速率相等,反应到达平衡 |

A.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,浓度变化量之比等于化学计量数之比,故△c(CH4)=
△c(H2)=
×0.75mol/L=0.25mol/L,故甲烷的转化率为:
×100%=25%,故A错误;
B.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,浓度变化量之比等于化学计量数之比,故△c(CO)=
△c(H2)=
×0.75mol/L=0.25mol/L,则v(CO)=
=0.025mol?L-1?min-1,故B错误;
C.平衡时H2的浓度变化量为0.75mol/L,则:
CH4(g)+H20(g)═C0(g)+3H2(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.25 0.250.250.75
平衡(mol/L):0.75 0.75 0.25 0.75
故该温度下平衡常数k=
=O.1875mol2?L-2,故C错误;
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡状态,当CH4(g)的消耗速率与H20(g)的生成速率相等,等于化学计量数之比,说明到达平衡,故D正确;
故选D.
| 1 |
| 3 |
| 1 |
| 3 |
| 0.25mol/L |
| 1mol/L |
B.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,浓度变化量之比等于化学计量数之比,故△c(CO)=
| 1 |
| 3 |
| 1 |
| 3 |
| 0.25mol/L |
| 10min |
C.平衡时H2的浓度变化量为0.75mol/L,则:
CH4(g)+H20(g)═C0(g)+3H2(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.25 0.250.250.75
平衡(mol/L):0.75 0.75 0.25 0.75
故该温度下平衡常数k=
| 0.25×0.753 |
| 0.75×0.75 |
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡状态,当CH4(g)的消耗速率与H20(g)的生成速率相等,等于化学计量数之比,说明到达平衡,故D正确;
故选D.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目