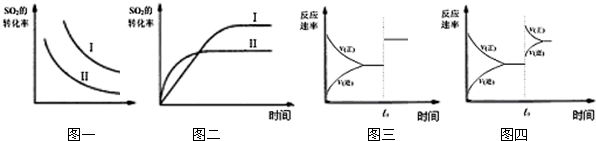
题目内容
如图中的曲线是在其他条件一定时反应:2NO(g)+O2(g)?2NO2(g)(正反应放热)中NO的最大转化率与温度的关系.图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是( )
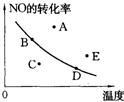
| A.A或E | B.C | C.B | D.D |

A.A、E点都在曲线上方,未达到平衡状态,要想达到同温度下的平衡状态,即由A、E点向下引垂直线到曲线上的一点,这样NO的转化率要减小,平衡向左移动,故v(正)<v(逆),故A错误;
B.C点在曲线下方,未达到平衡状态,要想达到同温度下的平衡状态,即由C点向上引垂直线到曲线上的一点,这样NO的转化率要增大,平衡向右移动,故v(正)>v(逆),故B正确;
C.B点在曲线上,处于平衡状态,v(正)=v(逆),故C错误;
D.D点在曲线上,处于平衡状态,v(正)=v(逆),故D错误;
故选:B.
B.C点在曲线下方,未达到平衡状态,要想达到同温度下的平衡状态,即由C点向上引垂直线到曲线上的一点,这样NO的转化率要增大,平衡向右移动,故v(正)>v(逆),故B正确;
C.B点在曲线上,处于平衡状态,v(正)=v(逆),故C错误;
D.D点在曲线上,处于平衡状态,v(正)=v(逆),故D错误;
故选:B.

练习册系列答案
相关题目