题目内容
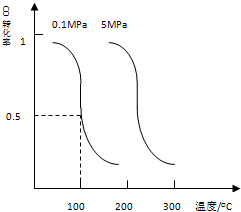
在一定温度下,反应H2(g)+X2(g)?2HX(g)的平衡常数为100,若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
| A.17% | B.5% | C.25% | D.33% |
在一定温度下,反应H2(g)+X2(g)?2HX(g)的平衡常数为100,则2HX(g)?H2(g)+X2(g)的平衡常数为0.01,
设该温度时HX(g)的最大分解率为x,
2HX(g)?H2(g)+X2(g)
初始1.0mol/L 0 0
反应xmol/L
mol/L
mol/L
平衡(1.0-x)mol/L
mol/L
mol/L
平衡常数=
=0.01,x=17%,
故选A.
设该温度时HX(g)的最大分解率为x,
2HX(g)?H2(g)+X2(g)
初始1.0mol/L 0 0
反应xmol/L
| x |
| 2 |
| x |
| 2 |
平衡(1.0-x)mol/L
| x |
| 2 |
| x |
| 2 |
平衡常数=
| ||||
| (1.0-x)2 |
故选A.

练习册系列答案
相关题目

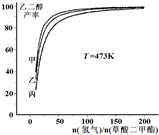 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=______.
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=______.