题目内容
6.质量都为4.2g的A气体和B气体,在标准状况下的体积分别为2.94L和3.36 L,则这两种气体的摩尔质量之比为( )| A. | 1:1 | B. | 15:13 | C. | 7:8 | D. | 8:7 |
分析 依据n=$\frac{m}{M}$分别计算AB的物质的量,依据阿伏伽德罗定律:同温同压条件下,气体的体积之比等于气体的物质的量之比解答.
解答 解:设A、B的摩尔质量分别为MA、MB,则质量都为4.2g的A气体和B气体物质的量分别为:$\frac{4.2}{{M}_{A}}$:$\frac{4.2}{{M}_{B}}$;依据阿伏伽德罗定律:同温同压条件下,气体的体积之比等于气体的物质的量之比,所以$\frac{4.2}{{M}_{A}}$:$\frac{4.2}{{M}_{B}}$=2.94L:3.36 L:解得MA:MB=8:7,
故选:D.
点评 本题考查摩尔质量的计算,明确物质的摩尔质量、气体的体积和物质的量的关系式是解答关键,题目难度不大,注意对基础知识的掌握.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
14.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 27 g铝原子最外层电子数为2NA | |
| B. | 2.4g镁与足量盐酸反应转移的电子数为0.1NA | |
| C. | 1 molH2O分子所含电子数为10NA | |
| D. | 标准状况下,22.4 L乙醇的分子数为NA |
1.下列反应的离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 氢氧化钡溶液跟稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 过氧化钠与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ |
18.下列说法不正确的是( )
| A. | 从100mL 0.1mol•L-1NaOH溶液中取出10ml,其浓度为0.1 mol/L | |
| B. | 常温常压下,1.4gN2与3.2gO2的体积比为1:2 | |
| C. | 标准状况下,0.1molCO与0.2molH2O的体积比为1:2 | |
| D. | 将10ml 0.1mol•L-1NaOH溶液稀释至100mL,其浓度为0.01 mol/L |
15.针对如图所示的乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的是( )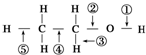
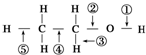
| A. | 与醋酸、浓硫酸共热发生酯化反应时,②键断裂 | |
| B. | 与金属钠反应时,①键断裂 | |
| C. | 与浓硫酸共热至170℃时,②、④键断裂 | |
| D. | 在加热和Ag催化下与O2反应时,①、③键断裂 |
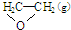 ),但是伴随副反应
),但是伴随副反应 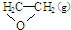 △H1
△H1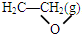 +$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.
+$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1. 食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O,样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.(已知K4[Fe(CN)6]•3H2O相对分子质量为422;K4[Fe(CN)6]相对分子质量为368)
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O,样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.(已知K4[Fe(CN)6]•3H2O相对分子质量为422;K4[Fe(CN)6]相对分子质量为368)