题目内容
2.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ/mol、1 411.0kJ/mol和1 366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )| A. | -44.2 kJ/mol | B. | +44.2 kJ/mol | C. | -330 kJ/mol | D. | +330 kJ/mol |
分析 已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则有:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;
③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol;
根据盖斯定律 ②-③可得C2H4(g)+H2O(l)=C2H5OH(l),反应热也进行相应的计算.
解答 解:已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则有:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;
③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol;
根据盖斯定律 ②-③可得:C2H4(g)+H2O(l)=C2H5OH(l)故△H=(-1411.0kJ/mol)-(-1366.8kJ/mol)=-44.2kJ/mol,
故选A.
点评 本题考查反应热的计算,题目难度中等,注意盖斯定律应用于反应热的计算.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
12.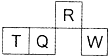 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R<Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的氧化物既能与强酸反应又能与强碱反应 |
13.饱和氯水久置后,溶液中的各种粒子:①Cl2 ②H+ ③Cl- ④HClO 减少的是( )
| A. | ①②④ | B. | ①②③ | C. | ①④ | D. | ②④ |
10.下列电离方程式中,正确的是( )
| A. | Na2SO4=2Na++SO4-2 | B. | H2CO3=2H++CO32- | ||
| C. | Al2 (SO4)3=2Al3++3 SO42- | D. | Ca(NO3)2=Ca2++2(NO3)2- |
17.常温下,将盐酸和一元碱MOH溶液等体积混合(忽略溶液体积变化),两种溶液的浓度和混合后所得溶液的pH如下表:下列判断错误的是( )
| 实验编号 | 盐酸的浓度(mol?L-1) | MOH溶液的浓度(mol?L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | 0.2 | c1 | 7 |
| 丙 | 0.1 | 0.1 | 5 |
| A. | 甲组混合溶液中M+水解程度较丙组中大,且a<5 | |
| B. | 甲组混合溶液中:c(Cl-)>c(M+)>c(H+)>c(OH-) | |
| C. | 乙组混合溶液中:c(M+)+c(MOH)>0.1mol?L-1,且c1>0.2 | |
| D. | 丙组混合溶液中:c(OH-)+c(MOH)=1×10-5 mol?L-1 |
7.下列溶液中的氯离子数目与50mL 1mol•L-1的AlCl3溶液中氯离子数目相等的是( )
| A. | 150mL 1 mol•L-1的NaCl | B. | 75mL 1mol•L-1的NH4Cl | ||
| C. | 150mL 3 mol•L-1的KCl | D. | 75mL 2 mol•L-1的CaCl2 |
14.ⅣA族元素锗与铝在周期表中处于对角线规则,性质相似,下列关于锗及其化合物的性质叙述中,错误的是( )
| A. | GeO2不溶于NaOH溶液 | B. | 单质锗具有导电性 | ||
| C. | 锗易与盐酸反应放出H2 | D. | 锗是一种重要的半导体材料 |