题目内容
14.ⅣA族元素锗与铝在周期表中处于对角线规则,性质相似,下列关于锗及其化合物的性质叙述中,错误的是( )| A. | GeO2不溶于NaOH溶液 | B. | 单质锗具有导电性 | ||
| C. | 锗易与盐酸反应放出H2 | D. | 锗是一种重要的半导体材料 |
分析 根据周期表中处于对角线规则,氧化铝是两性氧化物,金属铝具有导电性,铝易与盐酸反应放出氢气,Si、Ge同主族,根据性质相似推导出氧化锗和单质锗的性质,由此分析解答.
解答 解:A、氧化铝是两性氧化物,能与碱反应,所以GeO2溶于NaOH溶液,故A错误;
B、金属铝具有导电性,所以单质锗具有导电性,故B正确;
C、铝易与盐酸反应放出氢气,所以锗易与盐酸反应放出H2,故C正确;
D、锗位于金属与非金属性交界处,导电性能介于绝缘体和导体之间,硅和锗都是重要的半导体材料,故D正确;
故选A.
点评 本题考查Si的性质等,难度不大,注重基础知识的考查,注意元素的存在与性质的关系.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
5.下列实验误差分析错误的是( )
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏小 | |
| B. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
2.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ/mol、1 411.0kJ/mol和1 366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
| A. | -44.2 kJ/mol | B. | +44.2 kJ/mol | C. | -330 kJ/mol | D. | +330 kJ/mol |
9.下列实验目的可以实现或操作正确的是( )
| A. | 用托盘天平称取3.23 g NaCl固体 | |
| B. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| C. | 分液以后 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | |
| D. | 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌 |
19.下列说法正确的是( )
| A. | 可以用浓溴水区分苯和甲苯 | |
| B. | 淀粉和纤维素水解的最终产物均为果糖 | |
| C. | 实验室中,可以用电石和饱和食盐水制取乙炔 | |
| D. | H2N-CH2-COOH和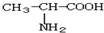 缩合只能形成一种二肽 缩合只能形成一种二肽 |
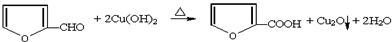
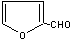 ,它是重要的化工原料,它在一定条件下可发生以下变化:
,它是重要的化工原料,它在一定条件下可发生以下变化: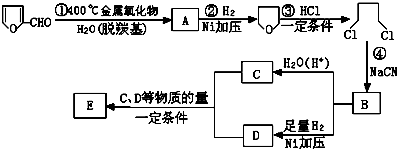
 或
或 .
.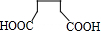 +n NH2CH2(CH2)4CH2NH2$\stackrel{一定条件}{→}$
+n NH2CH2(CH2)4CH2NH2$\stackrel{一定条件}{→}$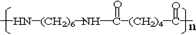 +(2n-1)H2O.
+(2n-1)H2O.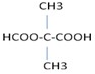 .
.