题目内容
10.下列电离方程式中,正确的是( )| A. | Na2SO4=2Na++SO4-2 | B. | H2CO3=2H++CO32- | ||
| C. | Al2 (SO4)3=2Al3++3 SO42- | D. | Ca(NO3)2=Ca2++2(NO3)2- |
分析 书写电离方程式,首先应分清电解质的强弱,强电解质完全电离,用等号;
弱电解质,部分电离,用可逆号;
多元弱酸分步电离;
同时注意离子的书写方式,据此解答.
解答 解:A.硫酸钠为强电解质,完全电离,电离方程式:Na2SO4=2Na++SO42-,故A错误;
B.碳酸为多元弱酸,分步电离,以第一步为主,电离方程式:H2CO3=H++HCO3-,故B错误;
C.硫酸铝为强电解质,完全电离,电离方程式:Al2 (SO4)3=2Al3++3 SO42-,故C正确;
D.硝酸钙为强电解质,完全电离,电离方程式:Ca(NO3)2=Ca2++2NO3-,故D错误;
故选:C.
点评 本题考查了电解质电离方程式书写,明确电解质强弱是解题关键,注意离子符号书写的准确性,注意多元弱酸分步电离,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.关于有机物HOOC-CH=CH-CH2OH,下列说法不正确的是( )
| A. | 分子式为C4H6O3,每摩尔该物质充分燃烧需消耗4mol O2 | |
| B. | 能发生取代反应、加成反应、氧化反应、中和反应 | |
| C. | 分别与足量钠、氢氧化钠、碳酸钠反应,生成物均为NaOOC-CH=CH-CH2OH | |
| D. | 该物质分子内和分子间都能发生酯化反应 |
1.下列关于元素周期表的说法中,错误的是( )
| A. | 元素原子的最外层电子数等于其所在族的序数 | |
| B. | 元素原子的电子层等于其所在周期的序数 | |
| C. | 同一主族元素的原子最外层电子数相同,化学性质相似 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
5.下列实验误差分析错误的是( )
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏小 | |
| B. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
15.关于同温同压下、等体积N2和CO的叙述:①质量相等 ②密度相等 ③所含分子数相等 ④所含电子数相等. 其中正确的是( )
| A. | ①②③④ | B. | ②③④ | C. | ②③ | D. | ③④ |
2.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ/mol、1 411.0kJ/mol和1 366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
| A. | -44.2 kJ/mol | B. | +44.2 kJ/mol | C. | -330 kJ/mol | D. | +330 kJ/mol |
19.下列说法正确的是( )
| A. | 可以用浓溴水区分苯和甲苯 | |
| B. | 淀粉和纤维素水解的最终产物均为果糖 | |
| C. | 实验室中,可以用电石和饱和食盐水制取乙炔 | |
| D. | H2N-CH2-COOH和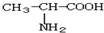 缩合只能形成一种二肽 缩合只能形成一种二肽 |
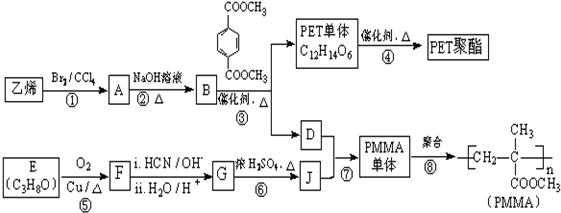
 (R、R′代表烃基,可相同也可不同)
(R、R′代表烃基,可相同也可不同)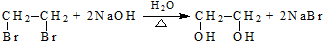 .
.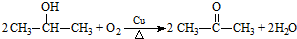 .
.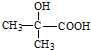 .
.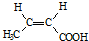 .
.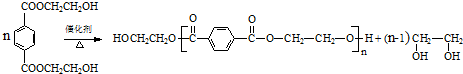 .
.