题目内容
【题目】尿素[CO(NH2)2]是可由无机化合物合成的有机化合物,通常用作植物的氮肥。
(1)合成尿素的主要反应如下:
i.2NH3(g)+CO2(g)![]()
![]() (l)(氨基甲酸铵)△H=-159.5kJ·mol-1
(l)(氨基甲酸铵)△H=-159.5kJ·mol-1
ii. ![]() (l)
(l)![]()
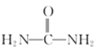 (l)+H2O(g)△H=+116.5kJ·mol-1
(l)+H2O(g)△H=+116.5kJ·mol-1
①CO2和NH3合成尿素的热化学方程式是____。
②工业上提高氨碳比[![]() (原料用量均增大),可以提高尿素的产率,结合反应i~ii,解释尿素产率提高的原因: ____。
(原料用量均增大),可以提高尿素的产率,结合反应i~ii,解释尿素产率提高的原因: ____。
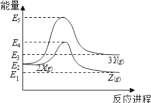
(2)某科研小组模拟工业合成尿素,一定条件下,在0.5 L的密闭容器中充入4 mol NH3和1molCO2,测得反应中各组分的物质的量随时间变化如图所示。.
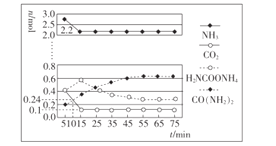
①反应进行到10 min时,用CO2表示反应i的速率v(CO2)=___。
②已知总反应的快慢由慢的一步反应决定,则合成尿素总反应进行到___min时达到平衡。
③合成尿素总反应的平衡常数为____。
(3)我国研制出金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。
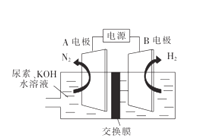
①电极B为___(填“阴”或“阳”)极。
②A电极的电极反应式为____________。
【答案】2NH3(g)+CO2(g)![]()
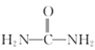 (l)+H2O(g)△H=-43kJ·mol-1 有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率
(l)+H2O(g)△H=-43kJ·mol-1 有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率 ![]() 55
55 ![]() 阴 CO(NH2)2-6e-+H2O=3H2↑+N2↑+6H+
阴 CO(NH2)2-6e-+H2O=3H2↑+N2↑+6H+
【解析】
(1)根据盖斯定律及平衡移动原理分析解答;(2)根据速率表达式及平衡常数表达式计算;(3)根据电解质原理分析解答。
(1)①由盖斯定律,CO2和NH2合成尿素的热化学方程式由反应ⅰ+反应ⅱ,可得:2NH3(g)+CO2(g)![]()
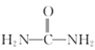 (l)+H2O(g) △H=-159.5kJ·mol-1+116.5kJ·mol-1=-43kJ·mol-1,故答案为:2NH3(g)+CO2(g)
(l)+H2O(g) △H=-159.5kJ·mol-1+116.5kJ·mol-1=-43kJ·mol-1,故答案为:2NH3(g)+CO2(g)![]()
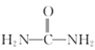 (l)+H2O(g) △H=-43kJ·mol-1;
(l)+H2O(g) △H=-43kJ·mol-1;
②根据反应ⅰ和反应ⅱ分析,提高氨碳比[![]() ,有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率,故答案为:有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率;
,有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率,故答案为:有利于反应ⅰ、ⅱ正向移动,从而提高尿素产率;
(2)①如图所示,10min时,n(CO2)=0.24mol,则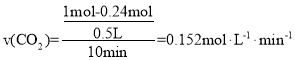 ,故答案为:
,故答案为:![]() ;
;
②根据图示知,反应ii反应慢,则合成尿素总反应进行到55min时到达平衡,故答案为:55;
③合成尿素总反应的平衡常数为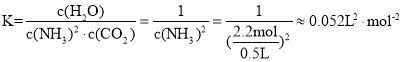 ,故答案为:
,故答案为:![]() ;
;
(3)①电极B上生成氢气,H元素化合价减低,得电子发生还原反应,所以B电极为阴极,故答案为:阴;
②A电极上CO(NH2)2转换生成N2,N化合价升高,失去电子,作为阳极,电极反应为:
CO(NH2)2-6e-+H2O=3H2↑+N2↑+6H+,故答案为:CO(NH2)2-6e-+H2O=3H2↑+N2↑+6H+。

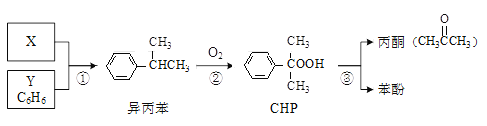
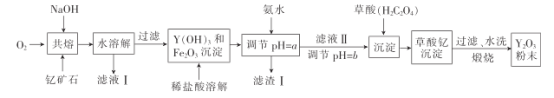
【题目】氧化钇主要用于制造微波磁性材料、军工材料、光学玻璃和显像管涂料等。工业上通过如下工艺流程用钇矿石(Y2 FeBe2 Si2O10,Y的化合价为+3)制取氧化钇。
已知:i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
(1)用氧化物的形式表示Y2 FeBe2 Si2O10为___, 钇矿石在熔融前要粉碎,目的是___。
(2)共熔时通人氧气的作用是_________。
(3)滤液I中溶质的主要成分是___ ( 假设钇矿石恰好与NaOH完全反应)。
(4)用氨水调节pH=a时,a的取值范围是_____,设计实验证明滤渣I沉淀完全: _______________。
(5)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式:_____________。
【题目】元素锰(Mn)在溶液中主要以Mn2+(近无色)、MnO4-(紫红色)、MnO42-(绿色)等形式存在,MnO2(棕黑色)、MnCO3(白色)为难溶于水的固体。回答下列问题:
(1)盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可通过间接的方法推算。现根据下列3个热化学反应方程式:
①MnO2(s)+CO(g)=MnO(s)+CO2(g) H=﹣150.6kJ/mol
②Mn3O4(s)+CO(g)=3MnO(s)+CO2(g) H=﹣54.4kJ/mol
③3Mn2O3v+CO(g)=2Mn3O4(s)+CO2(g) H=﹣142.3kJ/mol
写出CO气体还原MnO2固体得到Mn2O3固体和CO2气体的热化学反应方程式:_________
(2)①一定温度下,在5L的密闭容器中放入足量碳酸锰(固体所占体积忽略不计)发生反应:MnCO3(s)![]() MnO(s)+CO2(g),若前2min 内生成MnO的质量为7.1 g,则该段时间内v(CO2)=____________mol·L-1·min-1。
MnO(s)+CO2(g),若前2min 内生成MnO的质量为7.1 g,则该段时间内v(CO2)=____________mol·L-1·min-1。
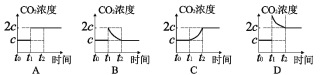
②保持温度不变,若t0时刻达到平衡时,CO2浓度为cmol/L;t1时刻,将容器体积缩小为原来的一半并固定不变,在t2时刻再次达到平衡,则下列图像正确的是_____(填字母)。
(3)已知Fe3+、Al3+、Mn2+的氢氧化物开始沉淀及沉淀完全时的pH如下表所示,当Al3+完全沉淀时,若要使Mn2+不沉淀,则Mn2+的最大浓度为_______________。(已知:Ksp[Mn(OH)2] = 1.9×1013)
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
开始沉淀pH | 1.8 | 4.1 | 8.3 |
完全沉淀pH | 3.2 | 5.0 | 9.8 |
(4)高锰酸钾在不同的条件下发生的反应如下:
MnO4-+5e-+8H+==Mn2++4H2O
MnO4-+3e-+2H2O==MnO2↓+4OH-;
MnO4-+e-==MnO42-
①从上述三个半反应中可以得出的结论是_______________。
②将SO2通入高锰酸钾溶液中,观察到的现象是________。
(5)向酸性高锰酸钾溶液中加入草酸溶液,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是_______________,写出反应的离子方程式____________________。