题目内容
【题目】氧化钇主要用于制造微波磁性材料、军工材料、光学玻璃和显像管涂料等。工业上通过如下工艺流程用钇矿石(Y2 FeBe2 Si2O10,Y的化合价为+3)制取氧化钇。
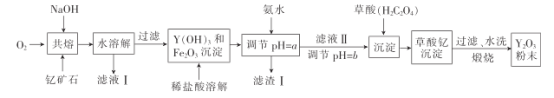
已知:i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
(1)用氧化物的形式表示Y2 FeBe2 Si2O10为___, 钇矿石在熔融前要粉碎,目的是___。
(2)共熔时通人氧气的作用是_________。
(3)滤液I中溶质的主要成分是___ ( 假设钇矿石恰好与NaOH完全反应)。
(4)用氨水调节pH=a时,a的取值范围是_____,设计实验证明滤渣I沉淀完全: _______________。
(5)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式:_____________。
【答案】Y2O3﹒FeO﹒2BeO﹒2SiO2 增大接触面积,加快反应速率,提高原料利用率 将+2价的铁氧化为+3价 Na2BeO2、Na2SiO3 ![]() 取少量滤液于试管中,向其中滴加几滴KSCN溶液,若溶液不变红,说明Fe(OH)3沉淀完全 Y2(C2O4)3·nH2O
取少量滤液于试管中,向其中滴加几滴KSCN溶液,若溶液不变红,说明Fe(OH)3沉淀完全 Y2(C2O4)3·nH2O![]() Y2O3+3CO2↑+3CO↑+n H2O
Y2O3+3CO2↑+3CO↑+n H2O
【解析】
(1)根据物质的组成及元素的化合价分析解答;(2)根据氧化还原反应原理及元素化合价变化分析解答;(3)根据流程中碱浸的原理分析滤液的组成;(4)根据开始沉淀及沉淀完全时的pH分析解答;(5)根据氧化还原反应原理分析解答。
(1)Y2FeBe2 Si2O10中Y的化合价为+3,用氧化物的形式表示Y2FeBe2 Si2O10为:Y2O3﹒FeO﹒2BeO﹒2SiO2;钇矿石在熔融前要粉碎,目的是增大接触面积,加快反应速率,提高原料利用率;故答案为:Y2O3﹒FeO﹒2BeO﹒2SiO2;增大接触面积,加快反应速率,提高原料利用率;
(2)Y2FeBe2 Si2O10中铁的化合价为+2,共熔、过滤后得到Fe2O3,则通入氧气的作用是将+2价的铁氧化为+3价,故答案为:将+2价的铁氧化为+3价;
(3)碱熔时,BeO和NaOH反应生成Na2BeO2,SiO2和NaOH反应生成Na2SiO3,Na2BeO2、Na2SiO3均能溶于水,则滤液Ⅰ中溶质的主要成分是Na2BeO2、Na2SiO3,故答案为:Na2BeO2、Na2SiO3;
(4)用氨水调节pH=a时,使Fe3+完全转变为Fe(OH)3沉淀而Y3+不沉淀,由表中数据可知a的取值范围是![]() ;取少量滤液于试管中,向其中滴加几滴KSCN溶液,若溶液不变红,说明Fe(OH)3沉淀完全;故答案为:
;取少量滤液于试管中,向其中滴加几滴KSCN溶液,若溶液不变红,说明Fe(OH)3沉淀完全;故答案为:![]() ;取少量滤液于试管中,向其中滴加几滴KSCN溶液,若溶液不变红,说明Fe(OH)3沉淀完全;
;取少量滤液于试管中,向其中滴加几滴KSCN溶液,若溶液不变红,说明Fe(OH)3沉淀完全;
(5)气体产物能使澄清石灰水变浑浊,说明反应生成了CO2,草酸钇中碳为+3价,而CO2中碳的化合价为+4价,说明发生了氧化还原反应,有化合价的升降,从而可判断出还有CO生成,则草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式为Y2(C2O4)3·nH2O![]() Y2O3+3CO2↑+3CO↑+n H2O,故答案为:Y2(C2O4)3·nH2O
Y2O3+3CO2↑+3CO↑+n H2O,故答案为:Y2(C2O4)3·nH2O![]() Y2O3+3CO2↑+3CO↑+n H2O。
Y2O3+3CO2↑+3CO↑+n H2O。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮
化钠的工艺流程:

已知 NaN3 能与 AgNO3 反应生成白色难溶于水的 AgN3;Ag2CrO4 呈红色,可溶于水。有关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | |
CH3OH | -9 | 64.7 | 与水互溶 |
水合肼(N2H4H2O) | 2 | 113.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 难溶于水,可溶于乙醇、乙醚 |
NaN3 | 275 | 300 | 易溶于水,难溶于乙醇 |
请回答:
(1)步骤Ⅰ中NaNO2 与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为_____;步骤Ⅱ中生成 NaN3 的化学方程式为_____
(2)实验室模拟步骤Ⅱ实验装置如图(装置中冷却水省略,下同):根据实验发现温度在 20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此需要采取的措施是_____。
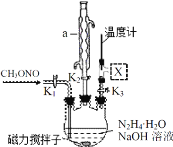
(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液 A 进行蒸馏的合理操作顺序是_____。
①打开 K1、K2,关闭 K3 ②打开 K3 ③加热 ④关闭 K1、K2
(4)步骤Ⅳ对溶液B 加热蒸发至溶液体积的 1/3,NaN3 结晶析出。
①步骤Ⅴ最好选用_____洗涤晶体。
A.水 B.乙醇 C.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色 K2CrO4 溶液作指示剂,将 AgNO3 标准溶液滴入样品溶液, 滴定终点现象为_________。AgNO3 溶液要装在_____滴定管里进行滴定。下列说法正确的是_____。
A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若发现滴液过量,可回滴样品溶液
E.若未等滴定管液面稳定就读数会导致测定结果偏高