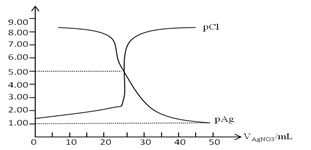
题目内容
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
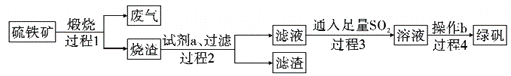
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
【答案】D
【解析】由制备绿矾流程可知,硫铁矿(主要成分:FeS2和SiO2)高温煅烧后的烧渣(主要成分:Fe2O3和SiO2)溶于硫酸,溶液中含Fe3+,过程2过滤除去二氧化硅,滤液中通入二氧化硫,将铁离子还原生成亚铁离子,过程4为蒸发浓缩、冷却结晶析出绿矾。A.根据上述分析,过程1,废气中含SO2,故A正确;B.因绿矾的酸根离子为硫酸根离子,则过程2最好用硫酸来溶解烧渣,故B正确;C. 过程3中二氧化硫将铁离子还原生成硫酸亚铁,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故C正确;D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,蒸干时绿矾受热失去结晶水,得不到纯净绿矾,故D错误;故选D。

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】海水中的成盐元素除了氯之外,还有溴和碘。
(1)工业上可用Cl2和NH4Cl溶液反应制取NCl3(NCl3既可用于漂白,又可用于柠檬等水果的熏蒸处理)。当用干燥洁净的玻璃棒蘸取NCl3滴到干燥的红色石蕊试纸上,试纸不褪色;若取NCl3滴入50-60oC热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,则试纸先变蓝后褪色。写出对应该现象的化学方程式:____________________________________________________。
(2)①碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:______KIO3+ ______KI + H2SO4 = ______K2SO4+_____I2+ ______
②上述反应生成的I2可用四氯化碳检验,现象为________________________________________。
(3)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
粒子 | I2 | Br2 | IO3- |
物质的量物的/mol | 0.5 | 1.3 | x |
则x= ______;原溶液中NaI的物质的量为______mol。