题目内容
5.工业生产纯碱的工艺流程示意图如下: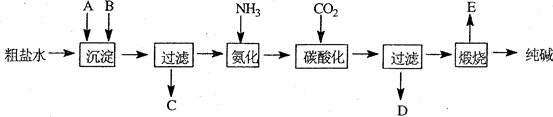
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源与石灰窑厂),写出A、B的化学式:ACa(OH)2或CaO、BNa2CO3.
(2)实验室提纯粗盐的实验操作依次为:取样、溶解沉淀、过滤、蒸发冷却结晶、过滤、烘干.
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是有晶体析出(或出现浑浊).碳酸化时没有析出碳酸钠晶体,其原因是碳酸钠溶解度比碳酸氢钠大.
(4)碳酸化后过滤,滤液D最主要的成分是NH4Cl(填写化学式),检验这一成分的阴离子的具体方法是:取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子.
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨.加石灰水后所发生的反应的离子方程式为:NH4++OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O滤液D加石灰水前先要加热,原因是防止加石灰水时产生碳酸钙沉淀.
(6)产品纯碱中含有碳酸氢钠,现用加热分解的方法测定纯碱中碳酸氢钠的质量分数,样品质量为m1,加热后剩余固体质量为m2,纯碱中碳酸氢钠的质量分数可表示为$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}$.
分析 本题是利用粗盐提纯得到的精制食盐水中,通往氨气到饱和后再通CO2,依据侯氏制碱法原理,会有碳酸氢钠沉淀生成,过滤洗涤干燥后将碳酸氢钠加热分解得到纯碱,可结合流程进行分析;
(1)根据题意A源于石灰窑,说明其是生石灰或熟石灰,再结合粗盐溶液里含有Mg2+、Ca2+来分析;
(2)根据实验室提纯粗盐的整个操作过程来回答;
(3)根据物质的溶解性结合实际生产来回答;
(4)根据题意知道通入二氧化碳后主要发生复分解反应结合质量守恒定律得知溶液中主要是NH4Cl,氯离子的检验可以用硝酸酸化的硝酸银;
(4)根据铵盐和强碱的反应实质来写反应,根据碳酸氢钠能和石灰水反应进行分析;
(6)根据碳酸氢钠受热易分解和碳酸钠受热稳定的性质来回答.
解答 解:(1)沉淀剂A源于石灰窑,说明其是生石灰或熟石灰;粗盐中的镁离子和钙离子一般用碳酸钠除去,故答案为:Ca(OH)2或CaO;Na2CO3;
(2)实验室提纯粗盐的整个操作过程为:取样、溶解、沉淀、过滤、蒸发、冷却结晶、过滤、烘干几步,故答案为:溶解;过滤;蒸发;过滤;
(3)纯碱生产中碳酸化时,会看到溶液中析出晶体,这是由于碳酸钠的溶解度大于碳酸氢钠,故答案为:有晶体析出(或出现浑浊);碳酸钠溶解度比碳酸氢钠大;
(4)根据操作过程,氨化后通入二氧化碳的溶液发生复分解反应,反应的化学方程式为:H2O+CO2+NH3+NaCl=NaHCO3+NH4Cl,最终得到NH4Cl还有碳酸氢钠等,碳酸氢钠溶解度很小而结晶,故酸化后滤液的主要成分是NH4Cl;检验其中的氯离子时,要经过取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子,故答案为:NH4Cl;取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子;
(5)滤液中主要含有的是氯化铵,其和石灰水反应时:NH4++OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O;由于滤液中还含有一定量的碳酸氢钠,故此加石灰水前先加热,是为防止加石灰水时产生碳酸钙沉淀,故答案为:NH4++OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O;防止加石灰水时产生碳酸钙沉淀;
(6)假设加热前纯碱的质量为m1,加热后的质量为m2,则加热损失的质量为:m1-m2,则纯碱中碳酸氢钠的质量为:84(m1-m2)/31m1;故纯碱中含有的碳酸氢钠的质量分数$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}$,故答案为:$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}$.
点评 此题考查了物质的提纯、化学实验基本操作、实验结果的处理等知识.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案①金属性最强的是铯
②氧化性最强的是锂原子
③在自然界中均以化合态形式存在
④它们的氧化物都只有M2O、M2O2两种形式
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥密度按Li-Cs顺序呈依次递增趋势
⑦离子半径:Rb+>K+>Na+、Cs>Cs+>K+
⑧都可以保存在煤油中.
| A. | ①③⑤⑦ | B. | ①④⑤⑥⑦ | C. | ①②⑥⑧ | D. | ①③④⑤ |
| A. | ①比②多 | B. | ②比①多 | C. | 一样多 | D. | 无法比较 |
| A. | 1.5mol FeCl2 | B. | 1.5mol FeCl3 | ||
| C. | 1.5mol Fe | D. | 1L 1.5mol•L-1 Fe2(SO4)3溶液 |
| A. | 向Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O=S↓+Cl-+2OH- | |
| B. | NH4HSO3溶于过量NaOH溶液中:HSO3-+OH-=SO32-+H2O | |
| C. | 向氯化银悬浊液中滴入饱和碘化钾溶液:Ag++I-=AgI | |
| D. | 标准状况下672mL Cl2通入100mL 1mol•L-1 FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| A. | 该反应的化学平衡常数表达式是K=$\frac{{{(C)}^{4}(D)}^{2}}{{{(A)}^{3}(B)}^{2}}$ | |
| B. | 此时,B的平衡转化率是40% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 增加B,平衡向右移动,B的平衡转化率增大 |
| A. | 容量瓶中原有少量蒸馏水 | B. | 溶解后所用的烧杯未洗涤 | ||
| C. | 定容时观察液面俯视 | D. | 摇匀后液面低于刻度线未再加水 |