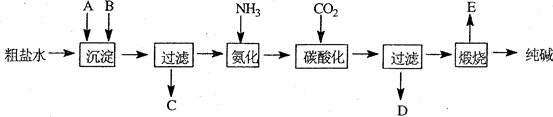
题目内容
14.下列化合物中,所含铁元素的物质的量最多的是( )| A. | 1.5mol FeCl2 | B. | 1.5mol FeCl3 | ||
| C. | 1.5mol Fe | D. | 1L 1.5mol•L-1 Fe2(SO4)3溶液 |
分析 1.5mol FeCl2含有1.5mol铁离子;1.5mol FeCl3含有1.5mol 铁离子;1.5mol Fe含有1.5mol铁原子;1L 1.5mol•L-1 Fe2(SO4)3溶液含有铁离子的物质的量为1L×1.5mol/L×2=3mol,据此判断解答.
解答 解:1.5mol FeCl2含有1.5mol铁离子;1.5mol FeCl3含有1.5mol 铁离子;1.5mol Fe含有1.5mol铁原子;1L 1.5mol•L-1 Fe2(SO4)3溶液含有铁离子的物质的量为1L×1.5mol/L×2=3mol,所以含有铁元素的物质的量最多是1L 1.5mol•L-1 Fe2(SO4)3溶液,
故选:D.
点评 本题考查了有关物质的量的计算,熟悉物质的组成是解题关键,注意电解质浓度与其电离产生离子浓度之间的关系,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.下列化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | Cl-的结构示意图: | |
| C. | NaCl的电子式: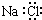 | |
| D. | NaHCO3的电离方程式:NaHCO3=Na++HCO3- |
5.下列说法中,不能说明苯中碳碳键不是单双键交替排布的事实是( )
| A. | 苯的键能、键长均相等 | B. | 苯的间位二元取代物只有一种 | ||
| C. | 苯不能使酸性高猛酸钾溶液褪色 | D. | 苯的邻位二元取代物只有一种 |
19.下列过程中熵增大的是( )
| A. | 氢气与氧气化合生成液态水 | B. | 氯化钠固体溶于水 | ||
| C. | 氧化铁变成Fe2O3 | D. | 水由气态变为液态 |
2. 水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数的表达式为K=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$,升高温度K将减小(填“增大”、“减小”或“不变”).
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡不移动(填“向左移”、“向右移”或“不移动”).
(3)上述反应在t0时刻达到平衡(如图),若在t1时刻缩小容器体积,请在图中继续画出t1时刻之后正、逆反应速率(ν正、ν逆)随时间的变化:
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
 水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1(1)该反应的平衡常数的表达式为K=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$,升高温度K将减小(填“增大”、“减小”或“不变”).
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡不移动(填“向左移”、“向右移”或“不移动”).
(3)上述反应在t0时刻达到平衡(如图),若在t1时刻缩小容器体积,请在图中继续画出t1时刻之后正、逆反应速率(ν正、ν逆)随时间的变化:
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.6 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |