题目内容
【题目】Mg、Al、Si、Cu是常用的生活材料。请回答下列问题:
(1)基态Cu2+中电子占有的能级数目是_______________。
(2)Mg、A1元素及其化合物有以下性质:
Mg元素及其化合物 | Al元素及其化合物 | |
电离能/(KJ/mol) | Mg:I1=738.14,I2=1451,I3=7733 | Al:I1=578,I2=1817,I3=2745 |
熔点/℃ | MgCl2:714 | AlCl3:190(2.5×105Pa) |
①Mg原子的配位数是12,属于__堆积方式解释第一电离能Mg比Al大的原因:_______________。
②解释熔点MgCl2比AlCl3高的原因:_______________。
③资料表明铝的氧化物分子式是Al2Cl6,其中Al的杂化方式是_____,从共用电子对提供的角度可知该分于中存在的化学键类型是_________.
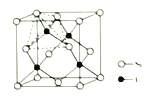
(3)金刚砂(SiC)的晶胞结构如图,若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,则Si原子的半径R为__cm(不必化简)。
【答案】 6 六方最密 Al的价电子结构是3s23p1,失去1个电子之后就是3s2稳定结构,Mg是3s2稳定结构 MgC12是高子晶体,AlCl3是分子晶体 sp3 (极性)共价键、配位键 
【解析】(1)铜是29号元素,电子排布式为[Ar]3d10 4s1,基态Cu2+中电子占有的能级数目是6;(2) ①Mg原子的配位数是12,属于六方最密堆积方式;Al的价电子结构是3s23p1,失去1个电子之后就是3s2稳定结构,Mg是3s2稳定结构,故第一电离能Mg比Al大;②MgC12是高子晶体,AlCl3是分子晶体,熔点MgCl2比AlCl3高;③每个铝原子和四个氯原子形成共价键,采取sp3杂化;Al2Cl6分子中正负电荷中心重合,属于非极性分子,该分子中存在(极性)共价键、配位键;(3)金刚砂(SiC)的晶胞结构如图,则硅原子个数为![]() ,碳原子为4个;若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,V=
,碳原子为4个;若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,V=![]() ,则Si原子的半径R为
,则Si原子的半径R为 。
。