题目内容
【题目】如图表示电解质溶液波燕面水中的c(H+)与c(OH-)在不同温度下的关系曲线,关于由A点到B点的变化,下列说法正确的是

A. 对Ba(OH)2溶液升高温度
B. 对NaCl溶液降低温度
C. 对H2SO4溶液降低温度
D. 对蒸馏水升高温度
【答案】A
【解析】由A点到B点的变化氢离子浓度增大,氢氧根离子浓度不变。A. 对Ba(OH)2溶液升高温度,水的电离平衡正向移动,氢离子浓度增大,但氢氧根离子浓度不变,选项A符合;B. 对NaCl溶液降低温度,水的电离平衡逆向移动,氢离子浓度、氢氧根离子浓度均增大,选项B不符合;C. 对H2SO4溶液降低温度,水的电离平衡逆向移动,氢离子浓度不变,氢氧根离子浓度减小,选项C不符合;D. 对蒸馏水升高温度,水的电离平衡正向移动,氢离子、氢氧根离子浓度均增大,选项D不符合。答案选A。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】Mg、Al、Si、Cu是常用的生活材料。请回答下列问题:
(1)基态Cu2+中电子占有的能级数目是_______________。
(2)Mg、A1元素及其化合物有以下性质:
Mg元素及其化合物 | Al元素及其化合物 | |
电离能/(KJ/mol) | Mg:I1=738.14,I2=1451,I3=7733 | Al:I1=578,I2=1817,I3=2745 |
熔点/℃ | MgCl2:714 | AlCl3:190(2.5×105Pa) |
①Mg原子的配位数是12,属于__堆积方式解释第一电离能Mg比Al大的原因:_______________。
②解释熔点MgCl2比AlCl3高的原因:_______________。
③资料表明铝的氧化物分子式是Al2Cl6,其中Al的杂化方式是_____,从共用电子对提供的角度可知该分于中存在的化学键类型是_________.
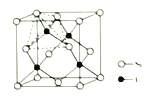
(3)金刚砂(SiC)的晶胞结构如图,若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,则Si原子的半径R为__cm(不必化简)。