题目内容
【题目】向四瓶盛有相同物质的量的NaOH溶液中通入体积不同的CO2气体后,得到①②③④四瓶溶液。分别向四瓶溶液中逐滴加入等浓度的盐酸,产生的气体体积V(CO2)与所加盐酸体积V(HCl)的关系如下图所示,且图②③④中分别有OA<AB、OA=AB、OA>AB,则下列分析与判断正确的是(忽略CO2的溶解)

A. ①中通入的CO2最少 B. ③中的溶质只有Na2CO3
C. 有两种溶质的是②和③ D. 若④中OA>2AB,则有c(NaOH)<c(Na2CO3)
【答案】B
【解析】
向四瓶盛有相同物质的量的NaOH溶液中通入体积不同的CO2气体后,得到①②③④四瓶溶液,因CO2的体积不同,则所得溶液中的溶质可能为:NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3,分别向四瓶溶液中逐滴加入等浓度的盐酸,可能发生的反应有:NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+CO2↑+H2O,A.图①中加入盐酸立即有CO2生成,说明溶质只有一种,即NaHCO3,说明①中通入的CO2最多,故A错误;B.图③中OA=AB,说明溶质只有Na2CO3,故B正确;C.由上述分析可知,③中只有一种溶质,图②中OA<AB,说明溶液中含有Na2CO3和NaHCO3两种溶质,故C错误;D.图④中OA>2AB,说明溶液中含有NaOH和Na2CO3两种溶质, 设溶液中Na2CO3的物质的量为amol,NaOH的物质的量为bmol,OA段发生的反应为:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3,AB段发生的反应为:NaHCO3+HCl=NaCl+CO2↑+H2O,由反应方程式可知,OA段消耗HCl的物质的量为(a+b)mol,AB段消耗HCl的物质的量为amol,则(a+b)>2a,得b>a,即c(NaOH)>c(Na2CO3),故D错误;答案选B。

【题目】Mg、Al、Si、Cu是常用的生活材料。请回答下列问题:
(1)基态Cu2+中电子占有的能级数目是_______________。
(2)Mg、A1元素及其化合物有以下性质:
Mg元素及其化合物 | Al元素及其化合物 | |
电离能/(KJ/mol) | Mg:I1=738.14,I2=1451,I3=7733 | Al:I1=578,I2=1817,I3=2745 |
熔点/℃ | MgCl2:714 | AlCl3:190(2.5×105Pa) |
①Mg原子的配位数是12,属于__堆积方式解释第一电离能Mg比Al大的原因:_______________。
②解释熔点MgCl2比AlCl3高的原因:_______________。
③资料表明铝的氧化物分子式是Al2Cl6,其中Al的杂化方式是_____,从共用电子对提供的角度可知该分于中存在的化学键类型是_________.
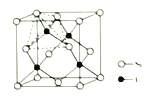
(3)金刚砂(SiC)的晶胞结构如图,若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,则Si原子的半径R为__cm(不必化简)。