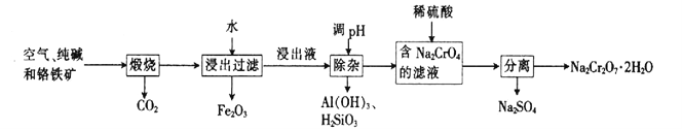
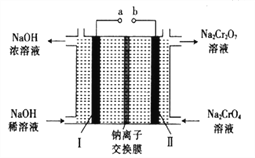
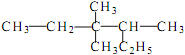
题目内容
【题目】金属晶体的形成是因为晶体中存在
①金属原子 ②金属阳离子 ③自由电子 ④阴离子
A. 只有① B. 只有③ C. ②③ D. ②④
【答案】C
【解析】请在此填写本题解析!
金属晶体内存在金属阳离子和自由电子,所以A、 B、 D都错,C正确。故本题正确答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】Mg、Al、Si、Cu是常用的生活材料。请回答下列问题:
(1)基态Cu2+中电子占有的能级数目是_______________。
(2)Mg、A1元素及其化合物有以下性质:
Mg元素及其化合物 | Al元素及其化合物 | |
电离能/(KJ/mol) | Mg:I1=738.14,I2=1451,I3=7733 | Al:I1=578,I2=1817,I3=2745 |
熔点/℃ | MgCl2:714 | AlCl3:190(2.5×105Pa) |
①Mg原子的配位数是12,属于__堆积方式解释第一电离能Mg比Al大的原因:_______________。
②解释熔点MgCl2比AlCl3高的原因:_______________。
③资料表明铝的氧化物分子式是Al2Cl6,其中Al的杂化方式是_____,从共用电子对提供的角度可知该分于中存在的化学键类型是_________.
(3)金刚砂(SiC)的晶胞结构如图,若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,则Si原子的半径R为__cm(不必化简)。
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H<0进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3) 与反应时间t的关系如下表:
2NH3(g) △H<0进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3) 与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2) /mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3) /mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1)反应速率最快的时间段是__________
A.0min-5min B .5min-10min C.10min-15min D. 15min-20min
(2)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mol/L、3mol/L、3mol/L,则此时v正 __________v逆 (填 “>”“<”或“=”)。
(3)NH3合成常见的化肥尿素【化学式为CO(NH2)2】分为三步,其中第一步为:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H=-160kJ/mol, 对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出128kJ的热量,NH3 的转化率为__________若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时。c(NH3)为__________。
NH2COONH4(s) △H=-160kJ/mol, 对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出128kJ的热量,NH3 的转化率为__________若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时。c(NH3)为__________。
(4)以氨气代替氢气研发氨燃料电池是当前科研的一个热点。
①氨燃料电池使用的电解质溶液是4mol·L-1的KOH溶液,电池反应为: 4NH3+3O2=2N2+6H2O。该反应每消耗3.4g NH3转移的电子数目为__________;
②氨燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,然后向所得溶液中加入19.6gCu(OH)2固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为__________L。

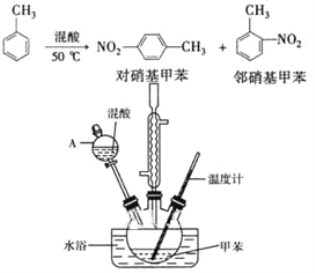
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是_______________________。反应中需不断搅拌,目的是__________________________________________。
(2)仪器A的名称是______,使用该仪器前必须进行的操作是____。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_____。
(4)分离反应后产物的方案如下:

其中,操作1的名称为______,操作2中需要使用下列仪器中的____(填序号)。
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(5)该实验中一硝基甲苯的产率为______(保留4位有效数字)。