题目内容
已知33As、35Br位于同一周期。下列关系正确的是
| A.原子半径:As>Cl>P |
| B.热稳定性:HCl>AsH3>HBr |
| C.还原性:As3->S2->Cl- |
| D.酸性:H3AsO4>H2SO4>H3PO4 |
C
解析

练习册系列答案
相关题目
卤素单质可以参与很多化学反应, 如:NF3可由NH3和F2在Cu催化剂存在下反应直接得到;反应①: 2NH3+3F2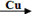 NF3+ 3NH4F
NF3+ 3NH4F
利用“化学蒸气转移法”制备TaS2晶体; 反应②:TaI4(g)+S2(g)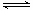 TaS2(s)+2I2(g)+Q kJ,Q>0
TaS2(s)+2I2(g)+Q kJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有_________种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有____________种自旋方向。
(2)反应①中:物质所属的晶体类型有________________________________;
并写出所有原子符合8电子稳定结构的化合物的电子式_______________________。
(3)反应②中:平衡常数表达式K=_____________________,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 ______________。
| A.平衡常数K增大 | B.S2的浓度减小 | C.I2的质量减小 | D.V(TaI4)逆 增大 |
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx,且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会____________(填增大或减小),其原因是________________________ 。
下列电子排布图能表示氮原子的最低能量状态的是( )
A.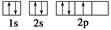 | B.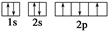 |
C.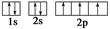 | D. |
X、Y、Z为短周期元素,原子序数依次增大。X的最外层电子数是Y原子最外层电子数的2倍,质子数比Y少5,X、Z在同主族。下列叙述不正确的是( )
| A.原子半径:Y>Z |
| B.X元素的一种单质可用于消毒杀菌 |
| C.Y的氧化物是工业制取Y单质的主要原料 |
| D.Z的单质在氧气中点燃可生成两种酸性氧化物 |
1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界不存在的磷元素的一种同位素(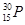 ):
):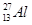 +
+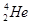 ―→
―→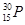 +
+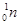 ,开创了人造核素的先河。下列有关说法不正确的是
,开创了人造核素的先河。下列有关说法不正确的是
| A.该变化说明原子核在一般的化学反应中也能发生变化 |
| B.该变化同样遵循质量守恒定律 |
C.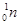 是一种电中性粒子 是一种电中性粒子 |
D.对于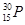 有:原子序数=质子数=中子数=核外电子数 有:原子序数=质子数=中子数=核外电子数 |
下列有关电负性的说法中正确的是( )。
| A.主族元素的电负性越大,元素原子的第一电离能一定越大 |
| B.在元素周期表中,元素电负性从左到右越来越大 |
| C.金属元素的电负性一定小于非金属元素的电负性 |
| D.在形成化合物时,电负性越小的元素越容易显正价 |
若短周期的两元素可形成原子个数比为2∶3的化合物,则这两种元素原子序数之差不可能是( )。
| A.1 | B.3 | C.5 | D.6 |
下列各原子或离子的电子排布式错误的是( )。
| A.C 1s22s22p2 |
| B.O2- 1s22s22p6 |
| C.Cr 1s22s22p63s23p63d44s2 |
| D.Al3+ 1s22s22p6 |