题目内容
1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界不存在的磷元素的一种同位素(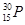 ):
):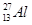 +
+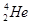 ―→
―→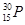 +
+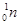 ,开创了人造核素的先河。下列有关说法不正确的是
,开创了人造核素的先河。下列有关说法不正确的是
| A.该变化说明原子核在一般的化学反应中也能发生变化 |
| B.该变化同样遵循质量守恒定律 |
C.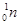 是一种电中性粒子 是一种电中性粒子 |
D.对于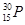 有:原子序数=质子数=中子数=核外电子数 有:原子序数=质子数=中子数=核外电子数 |
A
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
周期表中前20号元素X、Y、Z。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核·内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成含有42个电子的负一价阴离子。下列有关说法正确的是
| A.离子半径:X+ >Y- |
| B.Z元素的最高正化合价与最低负化合价代数和为4 |
| C.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 |
| D.Y的氢化物中存在离子键 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | ——- | -3 | -2 | |
已知,X、Y、Z和M下列说法正确的是
A.X、Z、R的最高价氧化物的水化物之间可两两相互反应
B.元素X和Q形成的化合物中不可能含有共价键
C.X、Z、M的单质分别与水反应,Y最剧烈
D.Y的氢化物的水溶液可用于雕刻玻璃
元素周期律和元素周期表是学习化学的重要工具,下列叙述不正确的是( )
| A.从左到右,元素周期表中的第13列为ⅢA族 |
| B.某ⅡA族元素的原子序数为x ,则与它同周期的ⅢA族元素的原子序数可能为x+25 |
| C.ⅥA族元素,随原子半径增大,对应气态氢化物的稳定性逐渐增强 |
| D.53号元素位于周期表P区、第五周期ⅦA族。 |
五种短周期金属元素在元素周期表中的相对位置如图所示,下列判断正确的是( )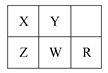
| A.原子半径:Z<W<R |
| B.金属性:X>Z |
| C.氢氧化物的碱性:Z>W>R |
| D.最外层电子数:X>Y |
下列说法中不正确的是 ( )
| A.同周期元素,随着核电荷数的增加,I1总体上呈现由小到大的变化趋势 |
| B.电离能越大,表示气态时该原子越易失电子 |
| C.元素的电负性越大,表示其原子在化合物中吸引电子能力越强 |
| D.电负性是相对的,所以没有单位 |
下列说法中肯定错误的是( )
| A.某原子K层上只有一个电子 |
| B.某原子M层上电子数为L层上电子数的4倍 |
| C.某离子M层上和L层上的电子数均为K层的4倍 |
| D.某离子的核电荷数与最外层电子数相等 |
已知33As、35Br位于同一周期。下列关系正确的是
| A.原子半径:As>Cl>P |
| B.热稳定性:HCl>AsH3>HBr |
| C.还原性:As3->S2->Cl- |
| D.酸性:H3AsO4>H2SO4>H3PO4 |
元素的原子半径在周期表中呈现周期性变化的根本原因是( )。
| A.原子的相对原子质量呈现周期性变化 |
| B.元素的化合价呈现周期性变化 |
| C.原子的性质呈现周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |