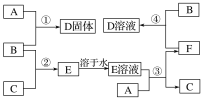
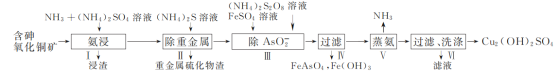
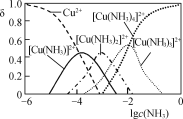
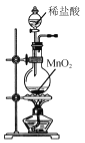
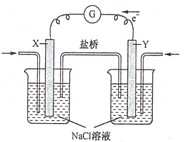
题目内容
【题目】在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac。
请回答下列问题:
(1)化合物Cu(NH3)3(CO)Ac中,铜元素的化合价为___。
(2)该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序是___。
(3)写出基态Cu2+的电子排布式:___,向Cu2+的溶液中加入过量NaOH溶液,可生成Cu2+配位数为4的配位离子,写出该配位离子的结构式___。
(4)CO与N2互为等电子体,二者沸点较高的是___,理由是____。
(5)在一定条件下,NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子和氮原子的杂化轨道类型分别是:___和___。
(6)Cu与O形成的某种化合物的晶胞结构如图所示。
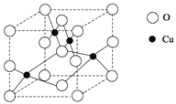
①在一个晶胞中,氧原子的数目为___。
②该化合物的化学式为____。
③晶胞的边长为apm,则该晶胞的密度为_____gcm-3。
【答案】+1 N>O>C 1s22s22p63s23p63d9 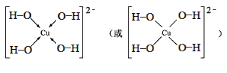 CO CO为极性分子,分子间作用力更强 sp2 sp3 4 CuO
CO CO为极性分子,分子间作用力更强 sp2 sp3 4 CuO ![]()
【解析】
(1)根据化合物结构,化合物中铜的化合价为+1价;
(2)该反应中第二周期元素有C、N、O三种元素,故三种元素的第一电离能从大到小为N>O>C;
(3)基态Cu2+的电子排布式为1s22s22p63s23p63d9;向Cu2+溶液中加入NaOH,可发生反应生成[Cu(OH)4]2-,其结构为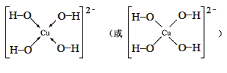 ;
;
(4)CO和N2互为等电子体,其中CO的沸点较高,原因是CO为极性分子,分子间作用力更强;
(5)尿素结构为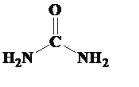 ,其中碳元素形成3个σ键,其杂化方式为sp2杂化;氮元素形成3个σ键,但是N原子本身还存在1对孤电子对,故N原子的杂化方式为sp3杂化;
,其中碳元素形成3个σ键,其杂化方式为sp2杂化;氮元素形成3个σ键,但是N原子本身还存在1对孤电子对,故N原子的杂化方式为sp3杂化;
(6)①根据晶胞结构,O占有晶胞的8个顶点、4个棱、2个面心和1个体心,故一个晶胞中有O原子![]() =4个;
=4个;
②晶胞内有4个Cu,故该晶胞的化学式为CuO;
③晶胞密度由晶胞质量除以晶胞体积计算,晶胞质量为![]() g,晶胞体积为(a
g,晶胞体积为(a![]() 10-10)3 cm3,故晶胞密度为
10-10)3 cm3,故晶胞密度为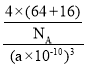 =
=![]() g·cm-3。
g·cm-3。

 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】按要求回答下列问题:
(1)现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
a. 以上物质中能导电的是________________________________。
b. 以上物质中属于电解质的是_______________________,属于非电解质的是_______________________。
c. 以上物质中,溶于水且能导电的物质是_______________________。
(2)胶体和溶液的本质区别是________________,鉴别胶体和溶液所采用的方法是观察是否能发生___________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O=4NaOH+ O2↑反应中,每消耗1 mol Na2O2生成_____ g O2。
②在NaHCO3的热分解反应中,每消耗168 g NaHCO3,标准状况下生成_____L CO2。
③Cl2+H2O=HCl+HClO反应中,标准状况下每消耗22.4LCl2,转移_____mol电子。
(4)在一个密闭容器中放入以下四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
物质 | M | N | Q | P |
反应前质量(g) | 50 | 1 | 3 | 12 |
反应后质量(g) | x | 26 | 3 | 30 |
①该变化的基本反应类型是_____反应;
②物质Q在反应中起的作用是_____。