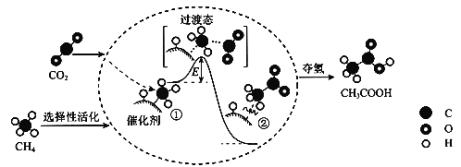
题目内容
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知D溶液为黄色,E溶液为无色,请回答:
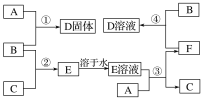
(1)A是__________,B是__________,C是_______________(填写化学式)。
(2)反应①的化学方程式为_______________________________。
(3)反应③的化学方程式为________________________________________。
(4)反应④的化学方程式为____________________________________________。
【答案】Fe Cl2 H2 2Fe+3Cl2![]() 2FeCl3 Fe+2HCl=FeCl2+H2↑ 2FeCl2+Cl2=2FeCl3
2FeCl3 Fe+2HCl=FeCl2+H2↑ 2FeCl2+Cl2=2FeCl3
【解析】
单质B为黄绿色气体,可知B为Cl2,C为单质为无色气体,B与C反应生成E,E溶液是无色的,则C为H2,E为HCl,A与盐酸生成氢气,A应为金属固体单质,A与盐酸反应后生成F为A的氯化物,F又能与氯气反应生成D,且A与氯气可以直接生成D,可推知A为Fe,根据转化关系可知,F为FeCl2,D为FeCl3,据此分析解答。
(1)根据以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe;Cl2,H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为2Fe+3Cl2![]() 2FeCl3,故答案为:2Fe+3Cl2
2FeCl3,故答案为:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(3)反应③为Fe和HCl的反应,反应的化学方程式为Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3。

 优学名师名题系列答案
优学名师名题系列答案【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
2CaSO4+2Cl2↑+2H2O。下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)该实验中A部分的装置是____(填写装置的序号)。

(2)装置B中饱和食盐水的作用是_______;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入________。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的氧化性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙色,说明_______。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是________。该现象______(填“能”或“不能”)说明溴的氧化性强于碘,原因是______。
(6)F的作用为__________。
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =__________________。
(2)该反应为__________反应(“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。