题目内容
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
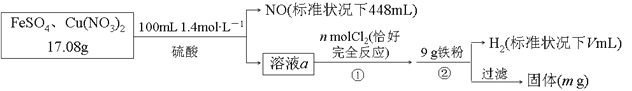
下列叙述中不正确的是
A. n=0.02 B. V=2240 C. m=3.2 D. 原混合物中FeSO4的质量分数约为89%
【答案】C
【解析】试题分析:根据流程图,加入铁粉有氢气放出,说明溶液a中有硫酸剩余,步骤①中有氯气反应,说明a中有亚铁离子,17.08gFeSO4和Cu(NO3)2的混合物与0.14mol硫酸反应,硝酸根完全被还原为NO,![]() ,
,![]() ;硝酸铜的质量是0.01mol×188g/mol=1.88g。硫酸亚铁的质量是17.08-1.88=15.2g,其物质的量是0.1mol;
;硝酸铜的质量是0.01mol×188g/mol=1.88g。硫酸亚铁的质量是17.08-1.88=15.2g,其物质的量是0.1mol;
根据方程式
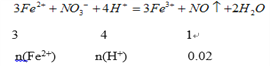
n(Fe2+)=0.06mol、n(H+)=0.08mol,溶液a中n(Fe2+)=0.1-0.06=0.04mol、n(H+)=0.14×2-0.08=0.2mol;
根据![]() ,0.04mol的Fe2+消耗氯气0.02mol,所以n=0.02;通入氯气后溶液中n(Fe3+)=0.1mol,根据
,0.04mol的Fe2+消耗氯气0.02mol,所以n=0.02;通入氯气后溶液中n(Fe3+)=0.1mol,根据![]() ,可知该反应消耗铁0.05mol,溶液中含有0.01mol铜离子,根据
,可知该反应消耗铁0.05mol,溶液中含有0.01mol铜离子,根据![]() ,可知消耗铁0.01mol,生成铜0.01mol;a溶液含有n(H+)=0.2mol,结合
,可知消耗铁0.01mol,生成铜0.01mol;a溶液含有n(H+)=0.2mol,结合![]() ,消耗铁0.1mol,生成氢气0.1mol。此时沉淀的质量=9-2.8-5.6-0.56+0.64=0.68g;故选C。
,消耗铁0.1mol,生成氢气0.1mol。此时沉淀的质量=9-2.8-5.6-0.56+0.64=0.68g;故选C。

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1]:
2NH3(g) ΔH=-92.4 kJ·mol-1]:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2c1>c3 B. a+b=92.4 C. 2p2<p3 D. α1+α3>1

