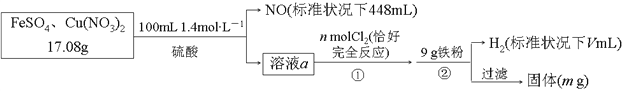
题目内容
【题目】某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
【答案】C
【解析】A.实验I中白色沉淀能溶于稀硫酸,但没有气泡,说明白色沉淀a是Al(OH)3,A正确;B. 实验2中白色沉淀溶解且有少量气泡,这说明白色沉淀中含有碳酸根离子,B正确;C.硫酸铝显酸性,碳酸钠显碱性,则根据实验过程可知实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH有关,C错误;D.白色沉淀表面有吸附的硫酸根,因此检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液,D正确,答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】表1是元素周期表的一部分:
氧 | X |
Y | Z |
表1
数据编号 | 滴入NaOH溶液的体积/mL | 溶液的pH | |
HX | HZ | ||
① | 0 | 3 | 1 |
② | 20.00 | a | 7 |
表2
25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00 mL浓度均为0.1000mol/ L的两种酸HX、HZ(忽略溶液体积变化),实验数据如表2,下列判断正确的是
A. 表格中a<7
B. 25℃时,HX的电离常数Ka=1×10-6
C. Y和Z两元素的简单氢化物受热分解,前者分解温度高
D. 0.1000mol/L Na2Y的水溶液中:c(Y2-)+c(HY-)+c(H2Y)=0.1000mol/L