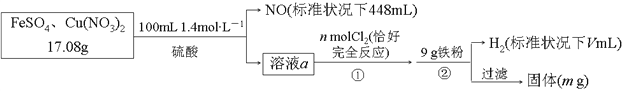
题目内容
【题目】成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
A. 木已成舟 B. 蜡炬成灰 C. 铁杵成针 D. 滴水成冰
【答案】B
【解析】试题分析:A.木已成舟只是物质形状的变化,没有新的物质生成,则没有涉及化学变化,故A错误;B.蜡炬成灰有新的物质生成,属于化学变化,且碳、氧元素的化合价发生变化,则属于氧化还原反应,故B正确; C.铁杵成针只是物质形状的变化,没有新的物质生成,则没有涉及化学变化,故C错误; D.滴水成冰只是物质形状的变化,没有新的物质生成,则没有涉及化学变化,故D错误;故选B。

【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△>0)某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置中SO2的吸收效率,B中试剂是________,表明SO2吸收效率低的实验现象是B中溶液________________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是_______、_______。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=12), 限用试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管、
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,_________。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分振荡溶解,_________。 | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取ag KIO3(相对分子质量:214)固体配成溶液,
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液溶液的体积为vmL 则c(Na2S2O3溶液)=_______mol·L-1。(只列出算式,不作运算)
已知:IO3-+I-+6H+=3I2+3H2O ,2S2O32-+I2=S4O62-+2I- 某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3的浓度可能_____(填“不受影响”、“偏低”或“偏高”) ,原因是________(用离子方程式表示)。
【题目】过氧化氢(H2O2)俗称双氧水。是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业。回答下列问题:
(1) H2O2的电子式为_______________。
(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜。
已知:Cu(s)+2H+ (aq)==Cu2+(aq) + H2(g) H= +64 kJ/mol
2H2O2(1) ==2H2O(l)+O2(g) H =-196 kJmol
H2(g) + l/2O2(g) ==H2O(l) H =-286 kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:__________________。
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4![]() (NH4)2S2O8+ H2↑,然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:
(NH4)2S2O8+ H2↑,然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:
①电解时阳极的电极反应式为___________________;
②(NH4)2 S2O8水解时发生反应的化学方程式为 ____________________。
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方案。
实验编号 | 温度 | 催化剂 | 浓度 |
甲组实验I | 25℃ | 三氧化二铁 | 10mL 5% H2O2 |
甲组实验II | 25℃ | 二氧化锰 | 10 mL 5% H2O2 |
甲、乙两小组得出如下图数据。
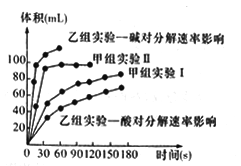
①甲小组实验得出的结论是______________________。
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在________(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为_______________;支持这一方案的理由是_______________________。
③已知过氧化氢还是一种极弱的二元酸:H2O2![]() H++HO2-(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-
H++HO2-(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-![]() HO2-+H2O,该反应中,正反应速率为V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为_________(保留3位有效数字)。
HO2-+H2O,该反应中,正反应速率为V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为_________(保留3位有效数字)。