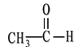题目内容
【题目】为排除![]() 、
、![]() 离子的干扰,在检验SO42-离子时,下列方法可行的是( )
离子的干扰,在检验SO42-离子时,下列方法可行的是( )
A.先加入BaCl2溶液,后再加入HNO3B.先加入HCl,后再加AgNO3溶液
C.先加入Ba(NO3)2溶液,后再加入HClD.先加入HCl,后再加入BaCl2溶液
【答案】D
【解析】
A.加入HNO3,可将SO32-氧化生成SO42-,不能检验SO42-的存在,选项A错误;
B.先加盐酸,后再加AgNO3溶液,可生成AgCl沉淀,不能检验SO42-的存在,选项B错误;
C.硝酸根离子在酸性环境中可以氧化SO32-离子生成SO42-离子,不能检验SO42-离子,选项C错误;
D.加入盐酸,CO32-离子和SO32-离子都反应生成气体,再加入BaCl2,反应生成白色沉淀,说明含有SO42-离子,选项D正确;
答案选。

【题目】二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.
工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO( g)+2H2(g)![]() CH3OH( g)△H1=-91kJ·mol-1
CH3OH( g)△H1=-91kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-24kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g)△H3=-41kJ·mol-1
CO2(g)+H2(g)△H3=-41kJ·mol-1
回答下列问题:
(1)新工艺的总反应为:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),该反应△H=______,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
CH3OCH3(g)+CO2(g),该反应△H=______,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度d.增加CO的浓度 e.分离出二甲醚
(2)已知反应④2CH3OH(g)![]()
![]() CH3OCH3(g)+H2O(g),某温度下,在1L密闭容器中加入CH3OH,反应10min时达到平衡,此时各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下,在1L密闭容器中加入CH3OH,反应10min时达到平衡,此时各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.01 | 0.2 | 0.2 |
①平衡常数表达式K=______,该温度的平衡常数为______。
②若加入CH3OH后,经10 min后达到平衡,该时间内的平均反应速率v(CH3OH)=________。
工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________________________________。