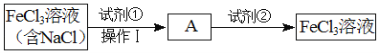
题目内容
【题目】25℃时,向25mL 0.1mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )
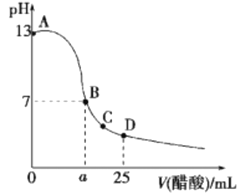
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. ![]()
C. C点对应的溶液中,水电离出的H+浓度大于10-7mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH) =2c(H+) -c(OH-)
【答案】B
【解析】
在25mL0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,二者之间相互反应,当恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+),注意根据电荷守恒思想来比较离子浓度大小。
A.在A、B间任意一点,溶液中NaOH为主要成分,离子浓度c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故A错误;
B.取a点所对应的B点进行计算,pH=7,则c(OH-)=c(H+)=10-7mol/L,又因为电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则有c(Na+)=c(CH3COO-),反应后c(CH3COOH)=![]() ,则c(Na+)=c(CH3COO-)=
,则c(Na+)=c(CH3COO-)=![]() ,醋酸的电离常数
,醋酸的电离常数![]() =
=![]() ,故B正确;
,故B正确;
C.C点对应的醋酸过量,所以抑制了水的电离,使水电离出的H+浓度小于10-7mol·L-1,故C错误;
D.D点时溶液中的醋酸与醋酸钠等量混合,根据物料守恒c(CH3COOH)+c(CH3COO-)=2 c(Na+),根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),将物料守恒代入电荷守恒可得c(CH3COO-)-c(CH3COOH) =2c(H+) -2c(OH-),故D错误。
故选B。

 名校课堂系列答案
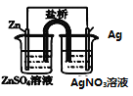
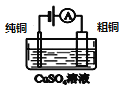
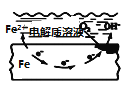
名校课堂系列答案【题目】下列表述不正确的是
A | B | C | D |
|
|
|
|
盐桥中的Cl-移向AgNO3溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 纯铜的电极反应式为:Cu2++2e-=Cu | 正极反应式为: O2+2H2O+4e-=4OH- |
A. AB. BC. CD. D