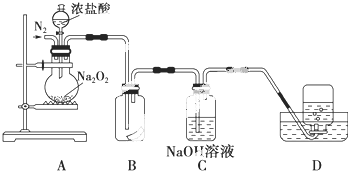
题目内容
18.设阿伏加德罗常数为NA,则下列说法正确的是( )| A. | 常温常压下,11.2 L甲烷中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3 mol二氧化硫中含有的氧原子数为0.3NA | |
| C. | 常温常压下,2 g H2的分子数为NA | |
| D. | 常温常压下,1 mol/L MgCl2溶液中含Cl-数为2NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、二氧化硫中含2个氧原子;
C、分子数N=$\frac{m}{M}{N}_{A}$;
D、溶液体积不明确.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L甲烷的物质的量小于0.5mol,故含有的氢原子数小于2NA个,故A错误;
B、二氧化硫中含2个氧原子,故0.3mol二氧化硫中含0.6mol氧原子即0.6NA个,故B错误;
C、2g氢气中的分子数N=$\frac{m}{M}{N}_{A}$=$\frac{2g}{2g/mol}$NA=NA个,故C正确;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
9.某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):a b e.
Ⅱ.某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀.甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数.
(1)按照甲同学的观点,发生反应的离子方程式为Cu2++2HCO3=CuCO3↓+CO2↑+H2O.
(2)两同学利用如图所示装置进行测定:

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化.具体操作依次为过滤、洗涤、干燥.
②装置E中碱石灰的作用是防止空气中CO2和水蒸气进入装置D.
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是cab(填选项序号,下同).若未进行步骤b,将使测量结果偏低.
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为$\frac{31n}{11m}$.
(3)丙同学认为还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量来测定沉淀中CuCO3的质量分数.
Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):a b e.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)按照甲同学的观点,发生反应的离子方程式为Cu2++2HCO3=CuCO3↓+CO2↑+H2O.
(2)两同学利用如图所示装置进行测定:

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化.具体操作依次为过滤、洗涤、干燥.
②装置E中碱石灰的作用是防止空气中CO2和水蒸气进入装置D.
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是cab(填选项序号,下同).若未进行步骤b,将使测量结果偏低.
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为$\frac{31n}{11m}$.
(3)丙同学认为还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量来测定沉淀中CuCO3的质量分数.
13.下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
①KHCO3溶液与石灰水反应,②Na2SO3溶液与稀盐酸反应,
③Si与烧碱溶液反应,④Fe与稀硝酸反应,
⑤金属钠在氧气中燃烧,⑥二氧化硫通入石灰水,
⑦铁在硫蒸气中燃烧.
①KHCO3溶液与石灰水反应,②Na2SO3溶液与稀盐酸反应,
③Si与烧碱溶液反应,④Fe与稀硝酸反应,
⑤金属钠在氧气中燃烧,⑥二氧化硫通入石灰水,
⑦铁在硫蒸气中燃烧.
| A. | ①④⑦ | B. | ①②④⑤ | C. | ③⑦ | D. | ③⑤⑦ |
3.在天平两端的两个烧杯中放有相同体积和相同物质的量浓度的盐酸,调节天平保持平衡.分别加入一定量的镁和铝,两种金属完全反应后,天平仍保持平衡,则加入镁和铝的物质的量之比为( )
| A. | 9:8 | B. | 11:12 | C. | 12:11 | D. | 3:4 |
10.下列有关实验的装置、试剂选用或操作正确的是( )
| A.配制0.10mol•L-1溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  | 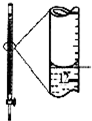 |
| A. | A | B. | B | C. | C | D. | D |
7.下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | 加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,SO42- | |
| B. | 含有NaClO的溶液中:K+,Al3+,Br-,S2- | |
| C. | 澄清透明溶液:Cu2+、SO42-、HCO3-、H+ | |
| D. | 使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42- |