题目内容
18.燃料电池的能量利用率比内燃机高,已应用于汽车中,如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )
| A. | a口放出气体为N2 | |
| B. | 电池总反应的产物与甲醇燃烧产物一样 | |
| C. | 用该电池电解精制铜,当消耗1mol甲醇时,可溶解粗铜中3mol铜 | |
| D. | 质子将由C1电极区经交换膜向C2电极区运动 |
分析 A、燃料电池的正极上是氧气的电子的还原反应;
B、燃料电池总反应是燃料燃烧的化学方程式;
C、根据电解池、燃料电池的电极反应式结合电子守恒进行计算即可;
D、在原电池中,阳离子从负极移向正极.
解答 解:A、该装置是燃料电池,通入燃料的电极是负极,通入空气的电极是正极,正极上是氧气的电子的还原反应,空气中的氧气得电子,所以剩余是氮气,即a口放出气体为N2,故A正确;
B、燃料电池总反应是燃料燃烧的化学方程式,在酸性介质下,甲醇燃料电池的总反应产物与甲醇燃烧产物一样,故B正确;
C、燃料电池总反应是:2CH4O+3O2=2CO2+4H2O,当消耗1mol甲醇时,转移电子是6mol,用该电池电解精制铜,可根据主反应:Cu-2e-=Cu2+,转移电子是6mol,溶解粗铜中3mol铜,但是阳极上先是活泼金属失电子,然后是金属铜失电子,所以当消耗1mol甲醇时,可溶解粗铜中铜的量小于3mol,故C错误;
D、该装置是燃料电池,通入燃料的电极是负极,通入空气的电极是正极,阳离子从负极移向正极,由C1电极区经交换膜向C2电极区运动,故D正确.
故选C.
点评 本题考查学生燃料电池的工作原理以及电极反应式的有关计算等知识,属于综合知识的考查,难度中等.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
9.M、N都是短周期元素,原子半径M>N,它们可形成化合物MN2,由此得出的正确判断是( )
| A. | M、N不可能在同一周期 | B. | M一定在N的下一周期 | ||
| C. | MN2肯定是共价化合物 | D. | M、N可能在同一主族 |
6.下列表示物质的化学用语正确的是( )
| A. | 乙醇的分子式:C2H5OH | B. | 羟基的电子式  | ||
| C. | NaCl的晶体模型: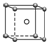 | D. | 甲烷分子的比例模型: |
10.设NA代表阿伏伽德罗常数,下列叙述正确的是( )
| A. | 将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中含有的NH4+数目小于NA | |
| B. | 24g石墨烯(单层石墨)中含有六元环的个数为NA | |
| C. | 标准状况下,6.72LNO2与足量水反应转移电子数目为0.2NA | |
| D. | 4.6gC2H6O加入足量的金属钠,充分作用,生成H2分子数一定为0.05NA |
2.下列各组物质中,不是按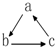 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | Fe | H2SO4 | Al(OH)3 | HNO3 |
| b | FeCl3 | SO2 | Na[Al(OH)4] | NO |
| c | FeCl2 | SO3 | Al2O3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
 ;
; ;
; ;
;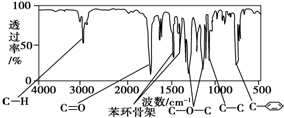 化合物A经李比希法测得其 中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.
化合物A经李比希法测得其 中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.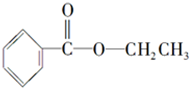 、
、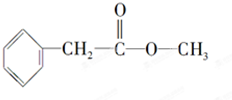 ;
; .
.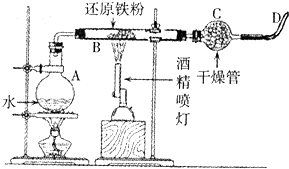 铁是人类使用最广泛的金属.
铁是人类使用最广泛的金属.