题目内容
9.M、N都是短周期元素,原子半径M>N,它们可形成化合物MN2,由此得出的正确判断是( )| A. | M、N不可能在同一周期 | B. | M一定在N的下一周期 | ||
| C. | MN2肯定是共价化合物 | D. | M、N可能在同一主族 |
分析 M、N都是短周期元素,原子半径M>N,它们可形成化合物MN2,M表现正化合价、N表现负化合价,若为同周期,同周期从左到右原子半径逐渐减小,与原子半径M>N一致;也可在不同周期,M化合价为偶数,只能是M在N的下一周期,M可以处于ⅡA、ⅣA族,化合物如MgF2、SiO2,以此来解答.
解答 解:A.M、N可能在同一周期,如化合物CO2,M为C,N为O,原子半径M>N,故A错误;
B.M、N可能在同一周期,如化合物CO2,故B错误;
C.若为化合物MgF2,为离子化合物,故C错误;
D.若为SO2,M为S,N为O,原子半径M>N,二者位于同主族,故D正确;
故选D.
点评 本题考查结构性质位置关系,属于开放性题目,涉及可能的物质很多,学生容易考虑不全,为易错题目,注意利用化合价来分析元素在周期表中可能的位置,利用列举法进行的解答,题目难度中等.

练习册系列答案
相关题目
19.下列有关说法或操作中,属于正确的有( )
| A. | 用丁达尔效应可区别NaCl溶液和Fe(OH)3胶体 | |
| B. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+ | |
| C. | 用25 mL量筒准确量取4.0 mol/L的盐酸5.62 mL | |
| D. | 配制1.2mol/LNaOH溶液时,若容量瓶中原来有少量蒸馏水,则使实验结果偏低 |
17.下列各组物质中,所含元素的质量分数相同,但它们既不属于同分异构体,也不属于同系物的是( )
| A. | 乙烯 丙烯 | B. | 异戊二烯 3-甲基-1-丁炔 | ||
| C. | 甲烷 乙烯 | D. | 苯 苯乙烯 |
14.沙漠中的仙人掌和海洋中的鲸,组成它们的化学元素( )
| A. | 完全相同 | B. | 含量无差别 | C. | 大体相同 | D. | 毫无联系 |
1.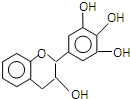 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 1 molEGC与足量溴水反应可消耗2 mol Br2 | |
| B. | EGC与苯酚属于同系物 | |
| C. | 在一定条件下,EGC中的羟基可被氯原子取代生成氯代烃 | |
| D. | 1mol EGC与含1.5mol Na2CO3的水溶液恰好完全反应生成1.5molCO2 |
18.燃料电池的能量利用率比内燃机高,已应用于汽车中,如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )


| A. | a口放出气体为N2 | |
| B. | 电池总反应的产物与甲醇燃烧产物一样 | |
| C. | 用该电池电解精制铜,当消耗1mol甲醇时,可溶解粗铜中3mol铜 | |
| D. | 质子将由C1电极区经交换膜向C2电极区运动 |
13.下列有关化学与生活、工业的叙述中,不正确的是( )
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染. |
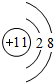 ,C的原子结构示意图是
,C的原子结构示意图是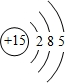 .
.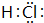 、A的氢氧化物的电子式
、A的氢氧化物的电子式 .
.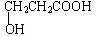 ,该物质易溶于水(填“难”或“易”),原因是能与水分子形成氢键,该物质的熔点明显高于相对分子质量相接近的烃类化合物的熔点,原因是该物质分子间可形成氢键.
,该物质易溶于水(填“难”或“易”),原因是能与水分子形成氢键,该物质的熔点明显高于相对分子质量相接近的烃类化合物的熔点,原因是该物质分子间可形成氢键.