题目内容
8.A、B、C、D均是短周期元素,原子序数依次增大.A元素原子最外层上的电子数为内层电子总数的2倍.A元素原子和B元素原子最外层电子数之差为2.B和C形成的化合物进行焰色反应火焰呈黄色.D元素的气态单质为黄绿色气体.(1)上述4种元素按照原子序数由小到大排列为Cl、Na、O、C;(填元素符号);
(2)A、B形成的化合物(比空气重)的电子式为
 ;
;(3)B、C的单质在加热条件下生成物质X,其中含有化学键的类型为离子键、共价键;X的电子式为
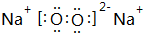 ;
;(4)D的离子结构示意图为
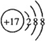 ;
;(5)Y是B的气态氢化物.常温下,将C的单质投入Y中,发生反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑.
分析 A、B、C、D均是短周期元素,A元素原子最外层上的电子数为内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,则A为碳元素;A元素原子和B元素原子最外层电子数之差为2,则B元素原子最外层电子数为6或2,B和C形成的化合物进行焰色反应火焰呈黄色,含有钠元素,则C为Na元素,B不能是金属元素,B的原子序数小于Na,故B为氧元素;D元素的气态单质为黄绿色气体,则E为Cl元素,据此解答.
解答 解:A、B、C、D均是短周期元素,A元素原子最外层上的电子数为内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,则A为碳元素;A元素原子和B元素原子最外层电子数之差为2,则B元素原子最外层电子数为6或2,B和C形成的化合物进行焰色反应火焰呈黄色,含有钠元素,则C为Na元素,B不能是金属元素,B的原子序数小于Na,故B为氧元素;D元素的气态单质为黄绿色气体,则E为Cl元素,
(1)上述4种元素按照原子序数由大到小排列为:Cl、Na、O、C,故答案为:Cl;Na;O;C;
(2)C、O形成的化合物(比空气重)为CO2,分子中C原子与O原子之间形成2对共用电子对,其电子式为 ,
,
故答案为: ;
;
(3)O、Na的单质在加热条件下生成物质X为Na2O2,含有离子键、共价键,其电子式为 ,
,
故答案为:离子键、共价键; ;
;
(4)D为Cl元素,其离子结构示意图为  ,故答案为:
,故答案为: ;
;
(5)Y是B的气态氢化物,则Y为水,常温下,将Na的单质投入水中,发生反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,注意对基础知识全面掌握.

练习册系列答案
相关题目
18.把CO2通入下列溶液后变浑浊的是( )
| A. | 醋酸钠溶液 | B. | 苯酚钠溶液 | ||
| C. | 氯化钙溶液 | D. | 饱和的碳酸钠溶液 |
19.下列有关说法或操作中,属于正确的有( )
| A. | 用丁达尔效应可区别NaCl溶液和Fe(OH)3胶体 | |
| B. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+ | |
| C. | 用25 mL量筒准确量取4.0 mol/L的盐酸5.62 mL | |
| D. | 配制1.2mol/LNaOH溶液时,若容量瓶中原来有少量蒸馏水,则使实验结果偏低 |
16.有机物中的羧基中-OH被卤原子取代所得的化合物称为酰卤,下列化合物中可以看做酰卤的是( )
| A. | CH3COCH2Cl | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
3.下列关于苯酚的叙述中,正确的是( )
| A. | 苯酚能与FeCl3溶液反应生成紫色沉淀 | |
| B. | 苯酚呈弱酸性,能使紫色石蕊试液显浅红色 | |
| C. | 向少量苯酚溶液中滴加饱和溴水,可观察到白色沉淀 | |
| D. | 苯酚有强腐蚀性,沾在皮肤上可用水洗涤 |
13.下列化学反应的有机产物中,存在同分异构体的是( )
| A. | (CH3)2CHCH2Br在碱性溶液中水解 | B. | 苯在常温下与Fe、液溴反应 | ||
| C. | 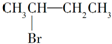 与NaOH的醇溶液共热反应 与NaOH的醇溶液共热反应 | D. | 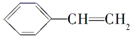 在催化剂存在下与H2完全加成 在催化剂存在下与H2完全加成 |
17.下列各组物质中,所含元素的质量分数相同,但它们既不属于同分异构体,也不属于同系物的是( )
| A. | 乙烯 丙烯 | B. | 异戊二烯 3-甲基-1-丁炔 | ||
| C. | 甲烷 乙烯 | D. | 苯 苯乙烯 |
18.燃料电池的能量利用率比内燃机高,已应用于汽车中,如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )


| A. | a口放出气体为N2 | |
| B. | 电池总反应的产物与甲醇燃烧产物一样 | |
| C. | 用该电池电解精制铜,当消耗1mol甲醇时,可溶解粗铜中3mol铜 | |
| D. | 质子将由C1电极区经交换膜向C2电极区运动 |
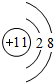 ,C的原子结构示意图是
,C的原子结构示意图是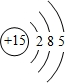 .
. 、A的氢氧化物的电子式
、A的氢氧化物的电子式 .
.