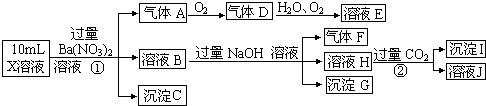
题目内容
【题目】试回答下列各题:
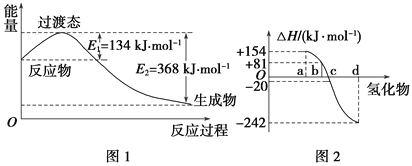
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ______________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
请填空:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: ___________________________________。
【答案】 NO2(g)+CO(g)===NO(g)+CO2(g) ΔH=-234 kJ·mol-1 434 H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ·mol-1
【解析】分析:(1)反应物能量高于生成物能量,反应是放热反应,反应焓变=E1-E2,依据热化学方程式书写方法书写热化学方程式;
(2)①根据△H=反应物总键能-生成物总键能计算;
②根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式。
详解:(1)根据NO2和CO反应生成CO2和NO过程中能量变化示意图可知,反应物能量高于生成物能量,反应是放热反应,反应焓变=E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol,所以NO2和CO反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)ΔH=-234 kJ·mol-1;
(2)①△H=436kJ/mol+247kJ/mol-2E(H-Cl)=-185kJ/mol,解得:E(H-Cl)=434kJ/mol;
②根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O;b为硒化氢的生成热数据,则硒化氢分解放热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol。

 口算题天天练系列答案
口算题天天练系列答案