题目内容
18.著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献.已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应.(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2.)下列说法正确的是( )| A. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI 高温_ CeI4+2H2↑ | |
| B. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+═Ce3++2Fe3+ | |
| C. | 金属Ce保存时,应该隔绝空气和水 | |
| D. | 铈的四种核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同素异形体 |
分析 A、氧化性:Ce4+>Fe3+>I-,不会生成CeI4;
B、根据电荷守恒判断即可;
C、根据题中信息分析;
D、具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素同位素.
解答 解:A、由于氧化性Ce4+>Fe3+>I-,铈溶于氢碘酸,产物不会生成CeI4,应该是CeI3,故A错误;
B、离子方程式中,Ce4++2Fe2+=Ce3++2Fe3+,左边总电荷为+8,右边总电荷为9,电荷不守恒,正确应为Ce4++Fe2+=Ce3++Fe3+,故B错误;
C、铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应,所以金属Ce保存时,应该隔绝空气和水,故C正确;
D、核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,具有相同质子数,不同中子数,故它们互为同位素,不是同素异形体,故D错误;
故选C.
点评 本题考查了氧化还原反应、金属性质、同位素等知识,主要是考查分析、利用信息,信息迁移和解决问题的能力,难度中等.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
14.下列实验事实与图象对应正确的是( )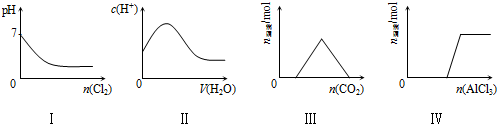

| A. | I表示向Na2SO3溶液中通入Cl2 | |
| B. | II表示向纯CH3COOH中逐滴加水并不断振荡 | |
| C. | III表示向KOH和Ca(OH)2混合液中通入CO2 | |
| D. | Ⅳ表示向NaOH溶液中逐滴加入AlCl3溶液并不断振荡 |
9.有德国重离子研究中心人工合成的第112号元素的正式名称为“Copernicium”,相应的元素符号位“Cn”.该元素的名称是为了纪念天文学家哥白尼而得名.该中心人工合成Cn的过程可表示为:7030Zn+20882Pb═277112Cn+10n.下列叙述中正确的是( )
| A. | 277112Cn的原子核内中子数比质子数多53 | |
| B. | Cn元素的相对原子质量为277 | |
| C. | 上述合成过程中属于化学变化 | |
| D. | Cn元素位于元素周期表的第六周期,是副族元素 |
13.下列应用或事实中,与胶体的制备或性质没有关系的是( )
| A. | 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| D. | 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
3.人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图.下列说法不正确的是( )


| A. | B是电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将增大 | |
| C. | 阳极室中发生的电极反应为:2Cl--2e-=Cl2↑ | |
| D. | 阳极室中发生的反应为:CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl |
10.下列有关化学用语表示正确的是( )
| A. | 氯化钙的电子式: | |
| B. | 168O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
7.区别SO2和CO2气体可选用的方法是( )
| A. | 通入品红溶液中 | B. | 用带火星的木条检验 | ||
| C. | 通入澄清石灰水中 | D. | 通入石蕊溶液中 |
8.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类.PVC被广泛用于食品、蔬菜的外包装,但它对人体有潜在危害.下列有关叙述中不正确的是( )
| A. | PVC保鲜膜属于链状聚合物,在高温时易熔化 | |
| B. | PVC的单体不能由PE的单体与氯化氢加成制得 | |
| C. | 鉴别PE和PVC,可将其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则为PVC;不变红,则为PE | |
| D. | 等质量的聚乙烯和乙烯分别完全燃烧,聚乙烯消耗的氧气多 |