题目内容
4.对于某些离子的检验及结论正确的是( )| A. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,可能有CO32- | |
| D. | 向待测液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,待测液中一定有NH4+ |
分析 A.由于加入盐酸引进了氯离子,无法判断原溶液中是否存在氯离子;
B.银离子能够与氯化钡反应生成不溶于盐酸的氯化银沉淀,所以溶液中不一定 存在硫酸根离子;
C.二氧化碳气体能够使澄清石灰水变浑浊,溶液中可能存在碳酸根离子;
D.湿润红色石蕊试纸遇碱性物质变蓝.
解答 解:A.加入盐酸酸化,再加入硝酸银产生白色沉淀,由于加入盐酸引进了干扰离子氯离子,所以无法判断原溶液中是否含有Cl-,故A错误;
B.加入氯化钡有白色沉淀产生,再加盐酸,沉淀不消失,该沉淀可能为硫酸钡或氯化银,原溶液中不一定存在SO42-,可能含有银离子,故B错误;
C.加入稀盐酸产生无色气体,将气体通澄清石灰水中,溶液变浑浊,该气体可能为二氧化碳或二氧化硫,原溶液中可能含CO32-,故C正确;
D.湿润红色石蕊试纸遇碱性物质变蓝,加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+,故D正确.
故选CD.
点评 本题考查了常见离子的检验,题目难度中等,注意掌握常见离子的性质及检验方法,在检验离子存在时,必须排除干扰离子,做到实验方案的严密性;选项B为易错点,注意可能存在与一定存在的关系.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案
相关题目
14.已知SO32-+I2+H2O=SO42-+2I-+2H+.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色.则下列关于该溶液组成的判断正确的是( )
| A. | 肯定不含I- | B. | 肯定不含Cu2+ | C. | 可能含有SO32- | D. | 肯定不含有NH4+ |
12.下列做法不应该提倡或者不正确的是( )
| A. | 采取低碳、节俭的生活方式,深入农村和社区宣传环保知识 | |
| B. | 经常使用一次性筷子、纸杯、塑料袋等,按照规定对生活废弃物逛行分类放量 | |
| C. | 热纯碱可以去油污,明矾可以净化水,漂白粉可用于漂白织物 | |
| D. | 煮沸自来水可除去其中的Ca(HCO3)2,食醋可以除水垢 |
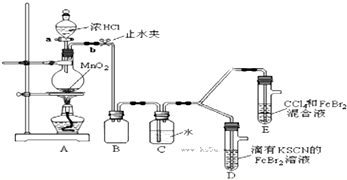
19.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①检查气体发生装置A的气密性的操作是关闭活塞a,打开止水夹b,将长导管末端浸入水中,用手捂住圆底烧瓶,导管口有气泡;松开手后,有水进入导管,则气密性良好;或方法二:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好..
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2.
ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应.ⅲ.AgClO、AgBrO均可溶于水.
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-?Fe(SCN)3平衡逆向移动而褪色,请设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理.或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为BrCl+2KI=KCl+KBr+I2.
(1)①检查气体发生装置A的气密性的操作是关闭活塞a,打开止水夹b,将长导管末端浸入水中,用手捂住圆底烧瓶,导管口有气泡;松开手后,有水进入导管,则气密性良好;或方法二:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好..
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2.
ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应.ⅲ.AgClO、AgBrO均可溶于水.
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-?Fe(SCN)3平衡逆向移动而褪色,请设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理.或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为BrCl+2KI=KCl+KBr+I2.

16.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12LSO3所含的原子数是0.2NA | |
| B. | 3.9gNa2O2吸收足量的CO2时转移电子数是0.05NA | |
| C. | 20g重水中含有中子数为8NA | |
| D. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为3NA |
3.下列关于能量变化的叙述中不正确的是( )
| A. | 碳酸的电离为吸热过程,所以碳酸盐与盐酸反应放热 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,则含 40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量多于57.3 kJ | |
| C. | 通过NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,可知 1molH2O(l)完全电离需要吸热57.3kJ | |
| D. | 铝热反应为放热反应 |