题目内容
9.某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质),再利用的流程.流程中的滤液经过多次循环后用来后续制备氧化铁粉末.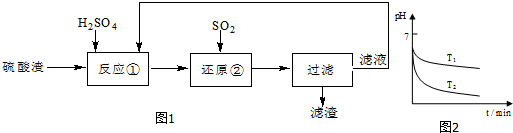
(1)为了加快反应①的反应速率,可采用的措施是将硫酸渣粉碎、适当增大硫酸的浓度、升高温度、搅拌等.(写出一点即可)
(2)“还原”是将Fe3+转化为Fe2+.在温度T1、T2(T1>T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如图2所示.得出结论:该反应的温度不宜过高.
①通入SO2气体“还原”时,试解释pH下降的原因是Fe3+将SO2的水溶液(H2SO3)氧化为H2SO4.
②相同时间内,T1温度下溶液的pH更高的原因是温度过高,SO2的溶解度下降.
(3)该流程中循环使用的物质是H2SO4.
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量.实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00mL.有关反应方程式如下:
2Fe3++2I-=2Fe2++I2; 2Na2S2O3+I2=Na2S4O6+2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程).
分析 本题以主要成分Fe2O3,含有少量的SiO2等杂质的硫酸渣为原料制备氧化铁粉末的实验设计,主要考查的是酸溶过程即用稀硫酸溶解氧化铁,再利用三价铁的氧化性氧化通入溶液中的SO2气体,得到硫酸和二价铁,涉及氧化还原反应的分析及数据处理;
(1)可结合影响反应速率的因素去考虑提高反应①的反应速率的方法;
(2)①在含有三价铁的溶液里通入SO2气体,发生的反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,根据反应原理分析溶液pH下降的原因;
②可参考温度对对气体溶解度的影响去考虑;
(3)流程度中箭头的指向可看出,最后过滤后的滤液中的硫酸可重新加入参加反应①,可见是可循环利用的物质;
(4)参照滴定原理及2Fe3++2I-=2Fe2++I2、2Na2S2O3+I2=Na2S4O6+2NaI建立Fe3+与Na2S2O3的关系式进行计算.
解答 解:(1)结合影响反应速率的因素,固体在酸溶时,可通过固体粉碎、升高温度、搅拌、提高硫酸的浓度来提高反应速率,故答案为:将硫酸渣粉碎、适当增大硫酸的浓度、升高温度、搅拌等;
(2)①Fe3+将SO2的水溶液(H2SO3)氧化为H2SO4,故溶液的pH会逐渐减少,也就是溶液的酸性增强,故答案为:Fe3+将SO2的水溶液(H2SO3)氧化为H2SO4;
②温度升高,可以加快反应速率,但气体的溶解度却减小了,参加反应的SO2的量减少,故相同时间内,T1温度下溶液的pH更高,故答案为:温度过高,SO2的溶解度下降;
(3)从流程图中可看出,可循环利用的物质是H2SO4,故答案为:H2SO4;
(4)由反应式可得关系:Fe3+~Na2S2O3,n(Fe3+)=n(Na2S2O3)=20.00×10-3 L×0.50mol/L×10=0.1 mol∴c(Fe3+)=$\frac{0.1mol}{20.00×1{0}^{-3}L}$=5.0mol/L,答:原溶液铁离子浓度为5.0mol/L.
点评 本题考查利用氧化还原反应的理论分析实验原理,涉及影响反应速率的因素及滴定原理的数据处理,难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 1mol氢气所占体积约为22.4L | |
| B. | 气态物质所占的体积主要由分子数目和分子间距离决定的 | |
| C. | 1molO2与1molO3所含的分子数目相等 | |
| D. | 物质的聚集状态不同主要是构成物质的基本粒子间的距离不同 |
①生成物的百分含量一定增加
②反应物转化率一定增大
③生成物的产量一定增加
④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
| A. | ①② | B. | ②⑤ | C. | ③⑤ | D. | ④⑥ |
| A. | Ca2+、K+、Cl-、SO32- | B. | NH4+、Fe2+、I-、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |
| A. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,可能有CO32- | |
| D. | 向待测液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,待测液中一定有NH4+ |
| A. | 氯水与足量的 FeBr2溶液反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| B. | NaHCO3溶液与 NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| C. | NaHCO3溶液与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | NaHCO3溶液与CaCl2;溶液反应:CO32-+Ca2+=CaCO3↓ |
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| D. | 水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |