题目内容
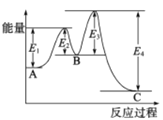
【题目】Ⅰ.化学电源在生产生活中有着广泛的应用,电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
(1)写出放电时负极的电极反应式:___;
(2)铅蓄电池放电时,溶液的pH将_________(填“增大”、“减小”或“不变”)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
(3)放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
Ⅱ.人们习惯上把电解饱和食盐水的工业叫做氯碱工业。如下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液。请回答以下问题:
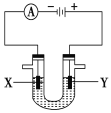
(4)X极上的电极反应式是:__________。
(5)检验Y电极反应产物的方法是_______。
(6)电解饱和NaCl溶液的离子方程式是:___________。
【答案】Pb -2e- + SO42- = PbSO4 增大 0.5mol Pb 2H++2e-=H2↑ 将湿润的淀粉KI试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
【解析】
(1)铅蓄电池中,负极是铅,负极上铅失电子发生氧化反应,正极上二氧化铅得电子发生还原反应;
(2)根据放电时总反应Pb+PbO2+2H2SO4═2PbSO4+2H2O进行计算回答;
(3)铅蓄电池充电时,电池正极和电源正极相连,电池负极和电源的负极相连,充电时的反应和放电时的反应互为逆过程;
(4)X电极上氢离子放电生成氢气;
(5)Y电极上氯离子放电生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验;
(6)电解食盐水生成氢氧化钠、氯气和氢气。
(1)铅蓄电池中,负极是铅,负极上铅失电子发生氧化反应:Pb-2e-+SO42-=PbSO4;
(2)放电时总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,反应转移2mol电子,消耗硫酸2mol,硫酸被消耗,所以溶液的酸性减弱,pH将增大,当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为0.5mol;
(3)放电完后,对该电池进行充电,在连接电源的负极一端是阴极,发生反应:PbSO4+2e-=Pb+SO42-,在连接电源的负极一端生成Pb;
(4)电极上氢离子放电生成氢气,电极反应为2H++2e-=H2↑;
(5)Y电极上氯离子放电生成氯气,电极反应为2Cl--2e-=Cl2↑,氯气可以用湿润的淀粉碘化钾试纸检验,如果湿润的淀粉碘化钾试纸变蓝色,则证明有氯气生成,
(6)电解食盐水生成氢氧化钠、氯气和氢气,电解池反应式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。

【题目】如图所示,四支电极均为铂电极,供选择的四组电解质溶液如下表:
组 | A | B | C | D |
甲槽 | NaOH溶液 | AgNO3溶液 | H2SO4溶液 | NaCl溶液 |
乙槽 | CuSO4溶液 | CuCl2溶液 | AgNO3溶液 | AgNO3溶液 |
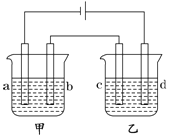
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则:
(1)应选用的电解液是________组。
(2)甲槽的电解方程式为:_____________;乙槽的电解方程式为:_______________。