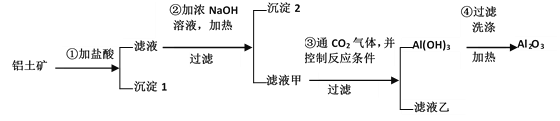
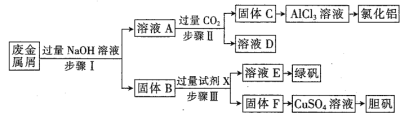
题目内容
【题目】废水中过量的氨氮(![]() 和
和![]() )会导致水体富营养化。某科研小组用
)会导致水体富营养化。某科研小组用![]() 氧化法处理氨氮废水。已知:①
氧化法处理氨氮废水。已知:①![]() 的氧化性比
的氧化性比![]() 强;②
强;②![]() 比
比![]() 更易被氧化;③国家相关标准要求经处理过的氨氮废水
更易被氧化;③国家相关标准要求经处理过的氨氮废水![]() 要控制在6~9 。
要控制在6~9 。
(1)![]() 时,
时,![]() 可与
可与![]() 反应生成
反应生成![]() 等无污染物质,该反应的离子方程式为___________。
等无污染物质,该反应的离子方程式为___________。
(2)进水![]() 对氨氮去除率和出水pH的影响分别如图1和图2所示:
对氨氮去除率和出水pH的影响分别如图1和图2所示:
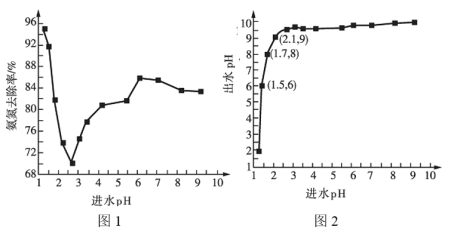
①进水![]() 在1.25~2.75范围内时,氨氮去除率随
在1.25~2.75范围内时,氨氮去除率随![]() 的升高迅速下降的原因是__________。
的升高迅速下降的原因是__________。
②进水![]() 在2.75~6范围内时,氨氮去除率随
在2.75~6范围内时,氨氮去除率随![]() 的升高而上升的原因是___________。
的升高而上升的原因是___________。
③进水![]() 应控制在____________左右为宜。
应控制在____________左右为宜。
(3)为研究空气对![]() 氢化氨氮的影响,其他条件不变,仅增加单位时间内通人空气的量,发现氨氮去除率几乎不变。其原因可能是______(填序号)
氢化氨氮的影响,其他条件不变,仅增加单位时间内通人空气的量,发现氨氮去除率几乎不变。其原因可能是______(填序号)
a.![]() 的氧化性比
的氧化性比![]() 弱
弱
b.![]() 氧化氨氮速率比
氧化氨氮速率比![]() 慢
慢
c.![]() 在废水中溶解度比较小
在废水中溶解度比较小
d.空气中的![]() 进入废水中
进入废水中
【答案】![]() 随着
随着![]() 的升高,
的升高,![]() 含量增大,氧化性降低,导致氨氯去除率下降 随着
含量增大,氧化性降低,导致氨氯去除率下降 随着![]() 的升高,氨氮废水中
的升高,氨氮废水中![]() 含量增大,而
含量增大,而![]() 比
比![]() 更易被氧化 1.5
更易被氧化 1.5 ![]()
【解析】
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,次氯酸根离子被还原为氯离子和水,结合电荷守恒、电子守恒、原子守恒配平书写离子方程式;
(2)①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降是c(OH-)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱;
②进水pH为2.75~6.00范围内氨氮去除率随pH升高而上升,氨气含量增大氨氮易被氧化;
③结合图象变化可知进水pH应控制在1.0左右;
(3)其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变,说明O2氧化氨氮速率比NaClO慢,比次氯酸钠氧化性弱,溶液中溶解的氧气少等原因。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,次氯酸根离子被还原为氯离子,结合电荷守恒、电子守恒、原子守恒配平书写离子方程式:3ClO-+2NH4+=N2↑+3Cl-+2H+;
(2)①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是:随着PH升高,NaClO含量增大,氧化性能降低,导致氨氮去除率下降;
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是:随着PH升高氨氮废水中氨气含量增大,氨氮更易被氧化;
③进水pH应控制在1.50左右,氨氮去除率会较大;
(3)研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是:O2的氧化性比NaClO弱、O2氧化氨氮速率比NaClO慢、O2在溶液中溶解度比较小;故答案为:abc。

【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
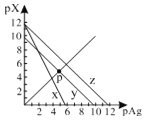
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012