题目内容
【题目】已知![]() 可以写成
可以写成![]() ,从某些性质看,
,从某些性质看,![]() 和
和![]() ,
,![]() 和
和![]() ,
,![]() 和
和![]() ,
,![]() 和
和![]() 两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
①![]()
②![]()
③![]()
④![]()
A.仅①B.仅②④C.全部D.仅①②④
【答案】C
【解析】
①NH3和H2O相当,可以依据2Na+2H2°═2NaOH+H2↑,类推得到反应为:2Na+2NH3═2NaNH2+H2↑,正确,故①正确;
②NH4+和H3O+相当,依据CaO+2HCl=CaCl2+H2O;类推得到反应:CaO+2NH4Cl ![]() CaCl2+2NH3↑+H2O,正确,故②正确;
CaCl2+2NH3↑+H2O,正确,故②正确;
③OH-和NH2-相当,N3-和O2-两两相当,依据Mg(OH)2=MgO+H2O,类推得到:3Mg(NH2)2 ![]() Mg3N2+4NH3↑正确,故③正确;
Mg3N2+4NH3↑正确,故③正确;
④OH-和NH2-相当,NH3和H2O相当,依据NH4Cl+NaOH=NaCl+NH3+H2O;类推得到:NH4Cl+NaNH2═NaCl+2NH3 正确;故④正确;
①②③④均正确,故答案为A。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案【题目】Ⅰ.金属冶炼与处理中常涉及离子反应和氧化还原反应。
(1)实验室常用无水乙醇处理少量残留的金属钠,写出反应的化学方程式_________。
(2)镁与碳在加强热时可生成易水解的MgC2,其水解的化学方程式为________。
(3)我国古代劳动人民曾利用明矾溶液除去铜器表面的铜锈[Cu2(OH)2CO3],请简要解释其原理:_______。
Ⅱ.(4)0.1 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序是:______________。
(5)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
A 容器内的混合气体的平均相对分子质量保持不变
B 水分子中断裂2NA个H-O键,同时氢分子中生成3NA个H-H键
C CH3OH和H2O的浓度保持不变
D 容器内的混合气体的密度保持不变
(6)现有反应CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 0.9 | 0.9 | 1.2 |
此时v正_______v逆(填“>”、“<”或“=”),v (CH3OH) =_______;当反应达到平衡状态时,混合气体中CH3OCH3体积分数(CH3OCH3)%=______%。
【题目】(1)A、B、C为同一短周期金属元素。依据下表数据分析,A、B、C三种元素的离子半径由大到小的顺序是_____。(用离子符号表示)
电离能/kJmol-1 | I1 | I2 | I3 | I4 |
A | 500 | 4600 | 6900 | 9500 |
B | 740 | 1500 | 7700 | 10500 |
C | 580 | 1800 | 2700 | 11600 |
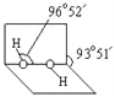
(2)已知H2O2分子的空间结构如图所示,H2O2分子中氧原子采取____________杂化;H2O2分子是______(填“极性分子”或“非极性分子”)。
(3)R是第4周期元素中未成对电子数最多的原子。R3+在溶液中存在如下转化:
R3+![]() R(OH)3
R(OH)3![]() [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为_____。
②[R(OH)4]-中存在的化学键是_____;1mol[R(OH)4]-离子中含有σ键的数目为_______mol。
A.离子键 B.极性键 C.非极性键D .配位键