题目内容
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)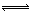 I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是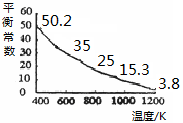
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
B
解析试题分析:A、根据示意图可知,随着温度升高,平衡常数逐渐减小,所以正反应为放热反应,正确;B、加入苯,发生萃取,I2溶于苯中,水溶液中I2的浓度减小,平衡向逆反应方向移动,错误;C、S难溶于KI溶液,所以运用该反应原理除去硫粉中少量的碘单质,正确;D、加入适量KI溶液,使上述平衡向右移动,可增大I2的溶解度,正确。
考点:本题考查化学平衡及应用。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
在密闭容器中进行反应:X(g)+3Y(g)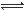 2Z(g),下列说法正确的是 ( )
2Z(g),下列说法正确的是 ( )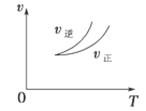
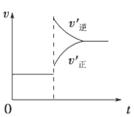
| A.左上图说明正反应为吸热反应 |
| B.反应达平衡后,增大压强气体密度将减小 |
| C.右上图可表示升高温度使平衡向逆反应方向移动 |
| D.右上图虚线可表示使用催化剂后引发的反应速率变化 |
在生活、生产中为增大反应速率而采取的措施合理的是
| A.食物放在冰箱中 |
| B.塑料制品中添加抑制剂 |
| C.在糕点包装内放置小包除氧剂 |
| D.燃煤发电时用煤粉代替煤块 |
一定条件下,反应:6H2 + 2CO2 C2H5OH + 3H2O的数据如下图所示。
C2H5OH + 3H2O的数据如下图所示。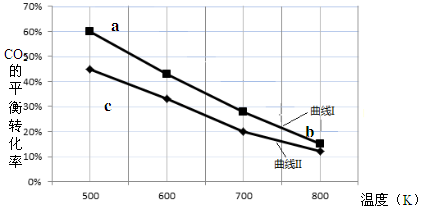

下列说法正确的是
| A.该反应的△H > 0 |
| B.达平衡时,v(H2)正 = v(CO2)逆 |
| C.b点对应的平衡常数K值大于c点 |
| D.a点对应的H2的平衡转化率为90 % |
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体。下列措施对改变该反应的速率几乎没有影响的是( )
| A.用相同浓度但温度较高的盐酸代替常温下的盐酸 |
| B.增大反应体系的压强或减小反应体系的压强 |
| C.改用相同质量但为粉末状态的碳酸钙代替块状碳酸钙 |
| D.改用与原盐酸含有相同H+浓度的稀硫酸 |
 kJ
kJ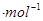 。在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示。下列说法错误的是
。在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示。下列说法错误的是
| A.前25min内反应放出的热量为46.lkJ |
| B.第25min改变的条件是将NH3从反应体系中分离出去 |
| C.若第60min时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D.若时段I中投入物质的浓度为原来的2倍,则反应物的转化率增大,平衡常数不变 |
在恒温条件下,将气体X、Y充入2 L密闭容器中反应生成气体Z。若各气体的物质的量随时间变化曲线如图所示,下列描述正确的是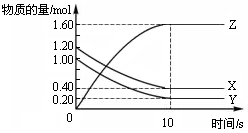
| A.前10s内 v(X)=0.08mol·L-1·s-1 |
| B.该反应的平衡常数K= 4 |
| C.平衡时X、Y的转化率相同 |
| D.达到平衡后,将容器体积扩大为 4 L,平衡向逆反应方向移动 |
下列有关说法正确的是
| A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
C.反应N2(g)+3H2(g) 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大 |
D.吸热反应“TiO2(s)+2Cl2(g) TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
一氧化碳是一种用途相当广泛的化工基础原料。利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
在一密闭容器中,放入镍粉并充入一定量的CO气体,已知该反应的平衡常数如下表
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
A.上述反应是熵增反应
B.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.25℃时,反应Ni(CO)4(g)
 Ni(s)+4CO(g)的平衡常数是0.5
Ni(s)+4CO(g)的平衡常数是0.5D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大