题目内容
一定条件下,反应:6H2 + 2CO2 C2H5OH + 3H2O的数据如下图所示。
C2H5OH + 3H2O的数据如下图所示。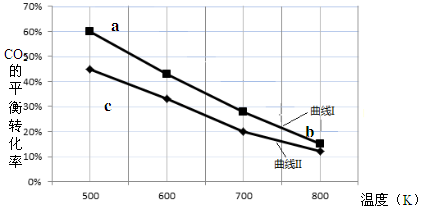

下列说法正确的是
| A.该反应的△H > 0 |
| B.达平衡时,v(H2)正 = v(CO2)逆 |
| C.b点对应的平衡常数K值大于c点 |
| D.a点对应的H2的平衡转化率为90 % |
D
解析试题分析:A、温度升高,二氧化碳的转化率降低,说明升高温度平衡逆向移动,所以正向为放热反应,该反应的△H <0,错误;B、氢气与二氧化碳的物质的量比是3:1,所以达平衡时,v(H2)正 ="3" v(CO2)逆 ,错误;C、该反应是放热反应,所以升高温度平衡常数K值减小,b点温度高于c点,则b点对应的平衡常数K值小于c点,错误;D、氢气与二氧化碳的物质的量比是3:1,a点的二氧化碳的平衡转化率是60%,曲线I:n(H2):n(CO2)=2,则氢气的平衡转化率是60%×3/2=90%,正确,答案选D。
考点:考查对化学平衡图像的分析能力,化学反应的热效应的判断,化学平衡常数的变化,转化率的计算

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案(9分)在2 L密闭容器内,800℃时反应2SO2(g)+O2(g) 2SO3(g)体系中,n(SO2)随时间的变化如下表:
2SO3(g)体系中,n(SO2)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0. 010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示SO3变化曲线的是_____,用O2表示从0 s~2 s内该反应的平均速率:v=__;
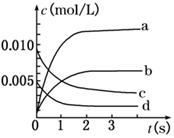
(3)能说明该反应已达到平衡状态的是________。
a.v(SO3)=2v(O2) b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为: COCl2(g) CO(g)+Cl2(g) ΔH<0下列有关说法不正确的是
CO(g)+Cl2(g) ΔH<0下列有关说法不正确的是
| A.在一定条件下,使用催化剂能加快反应速率 |
| B.当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变 |
| C.单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态 |
| D.平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
已知:3CH4(g) + 2N2(g) 3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量
3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量
之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示:下列说法正确的是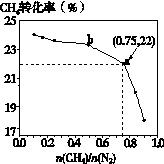
| A.n(CH4)/n(N2)越大,CH4的转化率越高 |
| B.n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大 |
| C.b点对应的平衡常数比a点的大 |
| D.a点对应的NH3的体积分数约为26% |
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq) I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是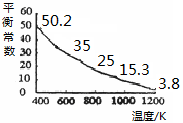
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
决定化学反应速率的主要因素是
| A.参加反应的物质本身的性质 | B.催化剂 |
| C.温度、压强以及反应物的接触面 | D.反应物的浓度 |
对于100mL1mol/L盐酸与铁片的反应,采取下列措施:①升高温度;②改用100mL3mol/L盐酸;③多用300mL1mol/L盐酸;④用等量铁粉代替铁片;⑤改用98%的硫酸。其中能使反应速率加快的是( )
| A.①③④ | B.①②④ | C.①②③④ | D.①②③⑤ |
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. 反应在前50 s 的平均速率v(PCl3)=" 0." 0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=" 0." 11 mol·L-1,则反应的驻H<0
C. 相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3和0. 20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2. 0 mol PCl3和2. 0 mol Cl2,达到平衡时,PCl3的转化率小于80%
 xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是
xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是