题目内容
在密闭容器中进行反应:X(g)+3Y(g) 2Z(g),下列说法正确的是 ( )
2Z(g),下列说法正确的是 ( )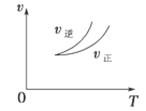
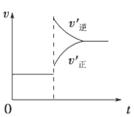
| A.左上图说明正反应为吸热反应 |
| B.反应达平衡后,增大压强气体密度将减小 |
| C.右上图可表示升高温度使平衡向逆反应方向移动 |
| D.右上图虚线可表示使用催化剂后引发的反应速率变化 |
C
解析试题分析:A.左上图说明当反应达到平衡后,升高温度,V正增大的少,V逆增大的多,平衡逆向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应为吸热反应。错误。B.反应达平衡后,增大压强,平衡正向移动,由于反应是在体积恒定的密闭容器内进行,气体的质量在反应前后保持不变,所以气体密度也不变。错误。C.在右上图改变条件后V正、V逆都增大,V逆增大的多,所以平衡逆向移动。由于升高温度,能使化学反应速率加快。因此可以表示升高温度使平衡向逆反应方向移动。正确。D.使用催化剂后正反应、逆反应的速率都加快,但是加快后的速率仍然相等,因此平衡不发生移动。错误。
考点:考查图像法在表示化学反应速率、化学平衡的移动中的应用的知识。

一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)="0.1" mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)="0.4" mol,则T1< T2
常温常压下将氢气和氧气混合在一起,即使过上几年,它们也不会发生化合反应生成水。然而只要给一个电火花,氢气就迅速与氧气反应生成水。反应过程中的能量变化如下图A所示。对比下图B中的情景,漫画中的羊供给石头的“能量”相当于图A中的( )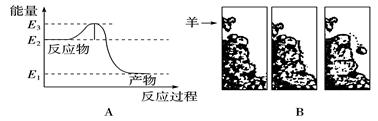
| A.E2 | B.E2-E1 | C.E3-E2 | D.E3 |
下列关于化学反应的自发性叙述中正确的是 ( )
| A.焓变小于0而熵变大于0的反应肯定是自发的 |
| B.焓变和熵变都小于0的反应肯定是自发的 |
| C.焓变和熵变都大于0的反应肯定是自发的 |
| D.熵变小于0而焓变大于0的反应肯定是自发的 |
(9分)在2 L密闭容器内,800℃时反应2SO2(g)+O2(g) 2SO3(g)体系中,n(SO2)随时间的变化如下表:
2SO3(g)体系中,n(SO2)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0. 010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示SO3变化曲线的是_____,用O2表示从0 s~2 s内该反应的平均速率:v=__;
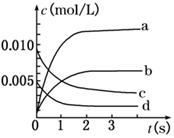
(3)能说明该反应已达到平衡状态的是________。
a.v(SO3)=2v(O2) b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.2SO2(g)+O2(g) 2SO3(g)ΔH<0 2SO3(g)ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
C.H2(g)+I2(g) 2HI(g)ΔH>0 2HI(g)ΔH>0 |
D.2A(g)+B(s) 2C(g)ΔH>0 2C(g)ΔH>0 |
为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为得出的结论不正确的是 ( )
| A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| B.将相同大小、形状的镁条和铝条分别与相同浓度的盐酸反应时,两者速率一样大 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管中再加入几滴氯化铁溶液,产生氧气的快慢不同 |
下图是可逆反应X2 + 3Y2 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )。
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )。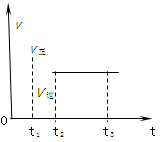
| A.t1时,只有正方向反应 |
| B.t2- t3,各物质的浓度不再发生变化 |
| C.t2- t3,反应不再发生 |
| D.t2时,反应未到达限度 |
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq) I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是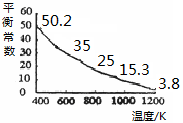
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |