题目内容
在恒温条件下,将气体X、Y充入2 L密闭容器中反应生成气体Z。若各气体的物质的量随时间变化曲线如图所示,下列描述正确的是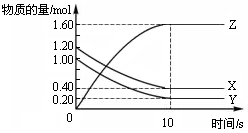
| A.前10s内 v(X)=0.08mol·L-1·s-1 |
| B.该反应的平衡常数K= 4 |
| C.平衡时X、Y的转化率相同 |
| D.达到平衡后,将容器体积扩大为 4 L,平衡向逆反应方向移动 |
B
解析试题分析:A.由物质的量与时间的关系曲线可知在前10s内 v(X)=(1.20-0.40)÷2L÷10s="0.04mol/(" L·s)。错误。B.从反应开始至达到平衡各物质的物质的量的变化是:X:减少0.80mol;Y减少0.80mol;Z增加1.60mol.后来随着时间的推移,各种物质的物质的量不变,反应达到平衡。因此反应方程式为X(g)+Y(g) 2Z(g)。在平衡时,各种物质的浓度分别是X:0.4mol/L;Y:0.40mol/L;Z:0.80mol/L。因此该反应的平衡常数K=0.802 ÷(0.4×0.4)=4.正确。 C.当反应达到平衡时X的转化率="0.8÷1.2=1/3;" 的转化率=0.8÷1=4/5,并不相同,错误。D.达到平衡后,将容器体积扩大为 4 L,即减小压强。由于该反应是反应前后气体体积相等的反应,所以减小压强,化学平衡不发生移动。错误。
2Z(g)。在平衡时,各种物质的浓度分别是X:0.4mol/L;Y:0.40mol/L;Z:0.80mol/L。因此该反应的平衡常数K=0.802 ÷(0.4×0.4)=4.正确。 C.当反应达到平衡时X的转化率="0.8÷1.2=1/3;" 的转化率=0.8÷1=4/5,并不相同,错误。D.达到平衡后,将容器体积扩大为 4 L,即减小压强。由于该反应是反应前后气体体积相等的反应,所以减小压强,化学平衡不发生移动。错误。
考点:考查化学方程式的书写、压强对化学平衡的影响、化学平衡常数和物质的转化率的计算的知识。

碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq) I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是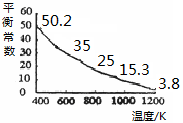
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
| A.加入一种反应物 | B.升高温度 |
| C.对平衡体系增加压强 | D.使用催化剂 |
可以证明可逆反应N2 + 3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H-H键断裂;②一个N≡N键断裂的同时,有6个N-H键断裂;③其它条件不变时,混合气体平均相对分子质量不再改变;④保持其它条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,混合气体的密度保持不变;⑦正反应速率v(H2) = 0.6 mol/(L·min),逆反应速率v(NH3) = 0.4 mol/(L·min)
| A.全部 | B.①③④⑤ | C.②③④⑤⑦ | D.③⑤⑥⑦ |
T℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
| A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1 |
B.容器中发生的反应可表示为3X(g)+Y(g)  2Z(g) 2Z(g) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
为了变废为宝,控制温室效应,工业上可用CO2来生产甲醇。一定条件下发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
| A.降低温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出来 |
| D.再充入1 mol CO2和3 mol H2 |
某可逆反应正向反应过程中能量变化如图所示,下列说法正确的是( )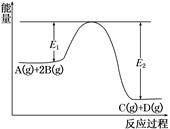
| A.该反应为吸热反应 |
| B.当反应达到平衡时,降低温度,A的转化率减小 |
| C.升高温度平衡常数K增大;压强增大,平衡向正反应方向移动 |
| D.加入催化剂,反应速率增大,E1减小,E2减小,反应热不变 |
 xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是
xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是 pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )