题目内容
10.下图中,表示可逆反应2A(g)+B(g)?2C(g)(正反应为放热反应)的正确图象为( )| A. | 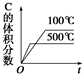 | B. | 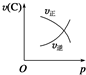 | C. | 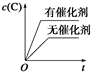 | D. | 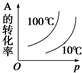 |
分析 A、先拐先平,温度高,反应是放热反应,升温平衡逆向进行;
B、反应是气体体积减小的反应,压强增大速率增大,正反应速率增大的多;
C、催化剂改变反应速率不能改变化学平衡;
D、压强不变,温度越高平衡逆向进行,A转化率减小,温度一定,压强越大反应正向进行,A转化率增大;
解答 解:A、先拐先平,温度高,反应是放热反应,升温平衡逆向进行,C体积分数减小,图象符合,故A正确;
B、反应是气体体积减小的反应,压强增大速率增大,正反应速率增大的多,图象中逆反应速率减小是错误,故B错误;
C、催化剂改变反应速率不能改变化学平衡,平衡后C的浓度不变,故C错误;
D、压强不变,温度越高平衡逆向进行,A转化率减小,图象中转化率曲线错误,温度一定,压强越大反应正向进行,A转化率增大,故D错误;
故选A.
点评 本题考查了图象变化趋势分析,化学平衡影响因素的分析应用,化学平衡移动原理的理解应用是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,2.8 g N2与C2H4的混合气体中含有的电子数为1.4NA | |
| B. | 标准状况下,1.12L NO与1.12L O2的混合物中含有的原子数为0.2NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 常温下,1L 0.1mol/L 的NH4NO3溶液中氧原子数为0.3NA |
15.下列化学用语表示正确的是( )
| A. | N2的电子式: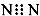 | B. | 钠离子的结构示意图: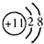 | ||
| C. | 乙烯的结构式:C2H4 | D. | CO2的比例模型: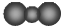 |
2.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 醋酸与NaHCO3溶液反应:H++HCO3-═CO2↑+H2O | |
| C. | 向KI溶液中加入FeCl3溶液:Fe3++2I-═Fe2++I2 | |
| D. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
19.化合物NaHCO3属于( )
| A. | 盐 | B. | 氧化物 | C. | 单质 | D. | 有机物 |
20.下列实验能达到预期目的是( )
| A. | 向葡萄糖溶液中加入足量NaOH溶液后,再加入新制氢氧化铜悬浊液,加热,可观察到产生黑色沉淀 | |
| B. | 向米汤中加入含碘的食盐,观察是否有颜色的变化,检验含碘食盐中是否含碘酸钾 | |
| C. | 向淀粉溶液中加入稀硫酸,加热后再用NaOH溶液中和并做银镜反应实验,检验淀粉是否水解 | |
| D. | 向乙酸乙酯中加入NaOH溶液再蒸馏,提纯乙酸乙酯 |
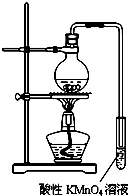 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.