题目内容
【题目】在2L密闭容器,800℃时发生如下反应:
2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)写出该反应的平衡常数表达式 。
已知:K(400℃)>K(350℃),则该反应是 热反应。
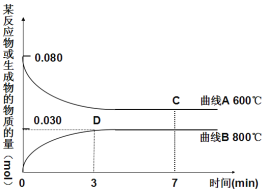
(2)右图中表示Cu2O的物质的量随时间变化的曲线是 (选填“A”或“B”),800℃时,0~3min内该反应的平均速率v (CO2)= 。
(3) 能说明该反应已达到平衡状态的是 。
a.v(CO)=v(CO2) b.容器内压强保持不变
c.v逆(CO)=v正(CO2) d.容器内气体的密度保持不变
(4)能使该反应的正反应速率增大,且平衡向正反应方向移动的是 。
A.增加CuO的量
B.适当升高温度
C.及时移去CO2
D.增大CO的浓度
E.选择高效催化剂
F.增大压强
【答案】(1)![]() ;吸;(2)B;0.005mol/(L·min);(3)c d;(4)BD;
;吸;(2)B;0.005mol/(L·min);(3)c d;(4)BD;
【解析】
试题分析:(1)已知2CuO(S)+CO(g) ![]() Cu2O(s)+CO2(g),则K=
Cu2O(s)+CO2(g),则K=![]() ;已知:K(400℃)>K(350℃),即升高温度K增大,平衡正移,所以正方向为吸热方向,故答案为:K=
;已知:K(400℃)>K(350℃),即升高温度K增大,平衡正移,所以正方向为吸热方向,故答案为:K=![]() ;吸;
;吸;
(2)Cu2O是生成物,物质的量增大,因此表示Cu2O的物质的量随时间变化的曲线是B;由图可知n(Cu2O)=0.03mol,根据方程式可知,n(CO)=n(Cu2O)=0.03mol,所以c(CO)=![]() =
=![]() =0.015mol/L,所以v(CO)=
=0.015mol/L,所以v(CO)=![]() =
=![]() =0.005mol/(Ls),故答案为:B;0.005mol/(Ls);
=0.005mol/(Ls),故答案为:B;0.005mol/(Ls);
(3)a.v(CO)=v(CO2),没有说明正速率和逆速率的关系,故错误;b.反应前后气体的物质的量不变,所以压强始终不变,所以不能用容器内压强判断平衡,故错误;c.v逆(CO)=v正(CO2),由于二者的计量数相等,所以v正(CO)=v正(CO2),因此v逆(CO)=v正(CO),所以是平衡状态,故正确;d.反应前后气体的体积不变,气体质量增大,所以密度增大,因此密度不变就是平衡状态,故正确;故答案为:cd;
(4)A.CuO是固体,增加CuO的量,速率不变,平衡不移动;B.适当升高温度,速率增大,平衡正移;C.及时移去CO2,速率减小,平衡正移;D.增大CO的浓度,速率增大,平衡正移;E.选择高效催化剂,速率增大,平衡不移动;F.增大压强,速率增大,平衡不移动;所以能使该反应的正反应速率增大,且平衡向正反应方向移动的是BD;故答案为:BD。