题目内容
【题目】已知常温下氯酸钾与浓盐酸反应放出氯气,现按图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,请对图中指定部位颜色做出正确描述。①_____②_____③_____④_____

【答案】黄绿色 橙色 蓝色 白色
【解析】
氯气为黄绿色气体,具有强氧化性,能够氧化溴离子、碘离子;氯气还能够和强碱溶液反应,据以上分析进行解答。
常温下氯酸钾与浓盐酸反应放出Cl2,①处充满黄绿色Cl2;氯气进入玻璃管后与②处NaBr溶液发生置换反应生成Br2,白色棉球变为橙色;氯气和③处KI溶液反应置换出I2,遇淀粉变蓝;④处利用氯气与碱液反应进行Cl2的尾气吸收,尽管反应生成的物质均为无色,但棉球本身是白色的,所以④处的颜色为白色;
故答案为:①黄绿色;②橙色;③蓝色;④ 白色。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如下图所示。

①上图中因为改变了反应条件,反应的活化能b___________(填“>”“<”或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=___________(用E1, E2的代数式表示)
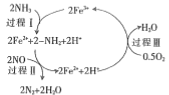
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为剂____,脱硝总反应的化学方程式为:___________。
(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密闭容器中,进行反应H2O(g)+CO(g)=CO2(g)+H2(g),得到如表所示的三组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①实验2:4min
②650℃时,若在此容器中充入2.0molH2O(g)、1.0molCO(g)、1.0molCO2(g)和xmolH2(g),要使反应在开始时间向正反应方向进行,则x应满足的条件是___________。
③若a=2.0,b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(α)的关系为α(H2O)___________(填“>”“<”或“=”)α(CO)。