题目内容
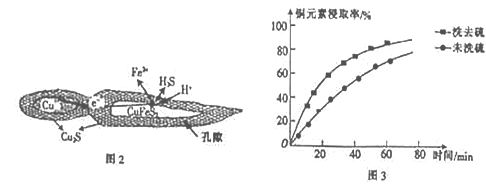
【题目】向含有1 mol HNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是

A. b表示Fe3+物质的量的变化线
B. n1=0.8
C. P点时,n(Fe2+)=0.45mol
D. 加入的铁为n3mol时,再向溶液中加入铜粉,铜粉可以溶解
【答案】C
【解析】试题分析:在酸性条件下,铁少量时可以被硝酸根氧化为Fe3+,铁足量后可以把Fe3+还原为Fe2+。由图像可知,a表示Fe3+、b表示Fe2+的变化曲线。n(NO3-)=1mol,n(H+)=3mol。A. b表示Fe3+物质的量的变化线,A不正确;B. 由反应Fe+NO3-+4H+=Fe3++NO↑+2H2O可知,NO3-过量,n1=![]() n(H+)=n(Fe3+)=0.75mol,B不正确;C. 由2Fe3++Fe=3Fe2+可知,P点时,n(Fe2+)= n(Fe3+)=0.75mol-
n(H+)=n(Fe3+)=0.75mol,B不正确;C. 由2Fe3++Fe=3Fe2+可知,P点时,n(Fe2+)= n(Fe3+)=0.75mol-![]() n(Fe2+),所以 n(Fe2+)=0.45mol,C正确;D. 由图像可知,加入的铁为n3mol时,n(Fe3+)=0,再向溶液中加入铜粉,铜粉不溶解,D不正确。本题选C。
n(Fe2+),所以 n(Fe2+)=0.45mol,C正确;D. 由图像可知,加入的铁为n3mol时,n(Fe3+)=0,再向溶液中加入铜粉,铜粉不溶解,D不正确。本题选C。

 阅读快车系列答案
阅读快车系列答案【题目】按要求回答问题:
(1)除去下列表格物质中的杂质(括号中是杂质),从所给试剂及操作方法中选出合适的药品及方法(填序号):
除杂试剂:A.溴水 B.饱和碳酸钠溶液 C.氢氧化钠溶液 D.乙醇
操作方法:E.蒸馏 F.分液 G.洗气 H.萃取
物质(括号中是杂质) | 除杂试剂 | 操作方法 |
①硝基苯(硝酸) | _____ | _____ |
②乙酸乙酯(乙酸) | _____ | _____ |
③甲烷(乙烯) | _____ | _____ |
(2)①乙酸中官能团的名称是__________________。
②工业上用乙烯水化法制备乙醇,反应的化学方程式是______________。
③红热的铜丝插入乙醇中反复几次发生反应,反应的化学方程式是______________,该反应类型为___________反应。
④丁烷有___________种同分异构体,其中___________(写名称)熔、沸点较低。