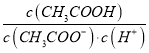题目内容
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。

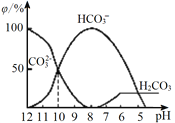
(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为__________________。
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为______;浸取时,在有氧环境下可维持Fe2+较高浓度,有关反应的离子方程式为________。
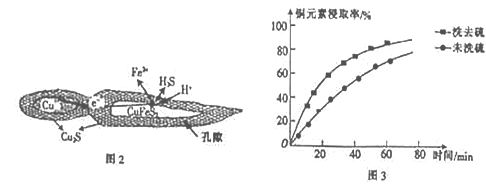
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3 所示,未洗硫时铜元素浸取率较低,其原因是_____________________。
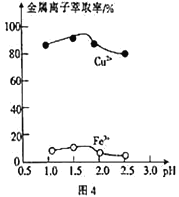
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4 所示,当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe2+萃取率降低的原因是_________________。
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为_______________。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、_____等操作可得到Fe2O3产品。
【答案】 CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑ 2mol 4Fe2++O2+4H+=4Fe3++2H2O 生成的硫覆盖在Cu2S表面,阻碍浸取 Fe3+水解程度随pH的升高而增大 32:7 洗涤 煅烧(或灼烧)
【解析】(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,根据图示,同时生成了Fe2+和H2S,反应的离子方程式为CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑,故答案为:CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑;
(2)①根据反应: Cu2S+4FeCl3=2CuCl2+4FeCl2+S,反应中S元素由-2价升高为0价,Cu元素由+1价升高为+2价,铁元素由+3价降低为+2价,转移4个电子,则每生成1molCuCl2,反应中转移电子2mol;浸取时,在有氧环境下可维持Fe3+较高浓度,是因为氧气能够氧化亚铁离子,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,故答案为:2mol;4Fe2++O2+4H+=4Fe3++2H2O;
②浸取过程中加入洗涤剂溶解硫时,如果未洗硫,生成的硫覆盖在Cu2S表面,阻碍浸取,会使铜元素浸取率较低,故答案为:生成的硫覆盖在Cu2S表面,阻碍浸取;
(3)Fe3+的水解程度随着pH的升高而增大,萃取率越低;故答案为:Fe3+的水解程度随着pH的升高而增大;
(4)在碱性条件下,Cu2+与N2H4反应生成氮气和铜,反应为:2Cu2++N2H4+4OH-=2Cu+N2↑+4H2O,反应中铜元素化合价降低被还原,铜为还原产物,N元素化合价升高被氧化,氮气为氧化产物,还原产物与氧化产物的质量之比![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(5)萃取后的“水相”中含有铁离子,加入氨水,反应生成氢氧化铁沉淀,煅烧可得到,方法为:在萃取后的“水相”中加入适量氨水,静置,过滤,洗涤,干燥,煅烧可得到Fe2O3产品,故答案为:洗涤;煅烧。

 步步高达标卷系列答案
步步高达标卷系列答案