题目内容
【题目】实现下列变化,需克服相同类型作用力的是
A.干冰和碘的升华B.冰的融化和水的分解
C.NaCl和HCl溶于水D.石英和氯化钠分别受热熔化
【答案】A
【解析】
A.干冰和碘升华克服的均为分子间作用力,A正确;
B.冰融化克服的分子间作用力,水分解破坏的是H和O之间的共价键,B错误;
C.NaCl溶于水,离子键被破坏,HCl溶于水电离出H+和Cl-,共价键被破坏,C错误;
D.石英受热熔化,共价键被破坏,NaCl熔化离子键被破坏,D错误;
答案选A。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):
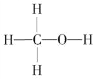
3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
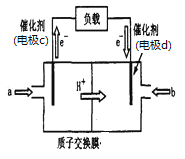
②废气中的CO2转化为甲醇可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。该燃料电池中通入甲醇的一极为____(填a或b),当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。
(2)H2还原法可消除氮氧化物
已知: N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8kJ·mol-1
①在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________。
② 以H2(g)为燃料可以设计氢气燃料电池,该电池以稀NaOH作电解质溶液,其负极电极反应式为___________________________________________________________,已知该电池的能量转换效率为86.4%,则该电池的比能量为________kW·h·kg-1(结果保留1位小数,比能量=![]() ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。
(3)微生物燃料电池(MFC)是一种现代化的氨氮去除技术。下图为MFC碳氮联合同时去除的示意图。
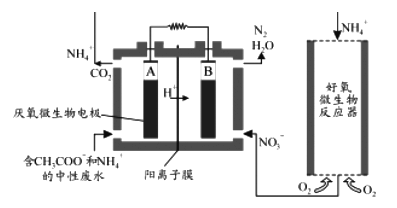
①已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式____________________________________________。
②解释该装置去除NH4+的原理_______________________________________________。
(4)利用“ Na—CO2”电池可将CO2变废为宝。
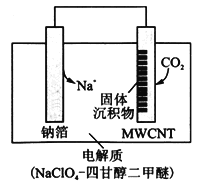
我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料(反应前两电极质量相等),总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为______________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。