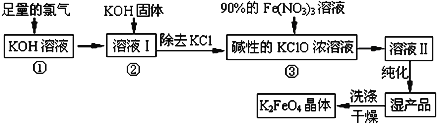
��Ŀ����
����Ŀ����1����һ��������п��Ͷ��100mL 18.5mol/L��Ũ�����У���п����ȫ�ܽ������ɵ�H2��SO2��33.6L����״��������ʱ��Һ������0.1mol H+�������֪��
��Ͷ��п��������Ϊ_____________g��
�����ɵ�H2��SO2�����ʵ���֮��Ϊ_____________��
��2��ȡ25.6 g Cu��һ������ijŨ�ȵ�ŨHNO3��Ӧ����ͭ��ȫ�ܽ���ռ���������NO��NO2��������ڱ�״���µ������11.2 L����
��������������ʵ���Ϊ_____________mol��
��NO�����ʵ���Ϊ_____________mol��NO2�����ʵ���Ϊ_____________mol��
�۵�ͭ��ȫ�ܽ�ʱ����Ӧ��ת�Ƶĵ�����ĿΪ_____________��
���𰸡�97.5 4:1 1.3 0.15 0.35 0.8NA
��������
��1������Zn+2H2SO4��Ũ��=ZnSO4+SO2��+H2O��Zn+H2SO4=ZnSO4+H2����֪��������ʵ�����Zn�����ʵ�����ȣ�
�����ݻ�ѧ����ʽ��Ĺ�ϵ��ʽ���㣻
��2�������ݷ���ʽ����������������ʵ�����
��ͭ��Ũ���ᷴӦ���ɶ�����������ϡ���ᷴӦ����NO������ת�Ƶ����غ�������������NO�����ʵ�����
����Ӧ��ͭʧȥ�ĵ���������������õ��ĵ���������
��1����n�����壩=![]() =1.5mol����Zn+2H2SO4��Ũ��=ZnSO4+SO2��+H2O��Zn+H2SO4=ZnSO4+H2������֪��������ʵ�����Zn�����ʵ�����ȣ���μӷ�Ӧ��ZnΪ1.5mol��65g/mol=97.5g���ʴ�Ϊ��97.5��
=1.5mol����Zn+2H2SO4��Ũ��=ZnSO4+SO2��+H2O��Zn+H2SO4=ZnSO4+H2������֪��������ʵ�����Zn�����ʵ�����ȣ���μӷ�Ӧ��ZnΪ1.5mol��65g/mol=97.5g���ʴ�Ϊ��97.5��
��n��H2SO4��=0.1L��18.5mol/L=1.85mol����ʱ��Һ������0.1molH+����֪�μӷ�Ӧ������Ϊ1.85mol-0.05mol=1.8mol�������ɵ�H2��SO2�����ʵ����ֱ�Ϊx��y����x+y=1.5������1molH2����1molH2SO4������1molSO2����2molH2SO4����x+2y=1.8����x=1.2mol��y=0.3mol�������ɵ�H2��SO2�����ʵ���֮��Ϊ0.3mol:1.2mol=4:1���ʴ�Ϊ��4:1��
��2����25.6gCu�����ʵ���Ϊ![]() =0.4mol��11.2LNO��NO2�����������ʵ���Ϊ
=0.4mol��11.2LNO��NO2�����������ʵ���Ϊ![]() =0.5mol����Ӧ������HNO3�����ʵ���Ϊ��n��Ӧ��HNO3��=2n��Cu(NO3)2��+n��NO+NO2��=2��0.4mol+0.5mol=1.3mol���ʴ�Ϊ��1.3mol��
=0.5mol����Ӧ������HNO3�����ʵ���Ϊ��n��Ӧ��HNO3��=2n��Cu(NO3)2��+n��NO+NO2��=2��0.4mol+0.5mol=1.3mol���ʴ�Ϊ��1.3mol��
��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ��Cu+4HNO3��Ũ��=Cu��NO3��2+2NO2��+2H2O��ͭ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��3Cu+8HNO3��ϡ��=3Cu��NO3��2+2NO��+4H2O�������ɵ�NO�����ʵ���Ϊxmol��NO2�����ʵ���Ϊymol����Ӧ��ͭʧȥ�ĵ���������������õ��ĵ�����������
x+y=![]() =0.5
=0.5
3��x+y=![]() ��2
��2
���x=0.15mol��y=0.35mol
�ʴ�Ϊ��0.15��0.35��
��Cu�����ʵ���Ϊ![]() =0.4mol����Ӧ��ͭʧȥ�ĵ���������������õ��ĵ������������Ե�ͭ��ȫ�ܽ�ʱ��Ӧ��ת�Ƶĵ�����ĿΪ2��0.4NA=0.8NA���ʴ�Ϊ��0.8NA��
=0.4mol����Ӧ��ͭʧȥ�ĵ���������������õ��ĵ������������Ե�ͭ��ȫ�ܽ�ʱ��Ӧ��ת�Ƶĵ�����ĿΪ2��0.4NA=0.8NA���ʴ�Ϊ��0.8NA��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���о�����ȿ���CO��CO2��Ӧ�öԽ���̬������������Ҫ�����塣
��1��CO��������������֪��
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ��H1=+489.0kJmol-1��
C(s)+CO2(g)=2CO(g) ��H2=+172.5kJmol-1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ____________________��
��2�������¯ú���õ���CO���������Ƴ�ȼ�ϵ�أ���KOH��ҺΪ���Һ����д���õ�صĸ�����Ӧʽ��__________________��
��3��CO2��H2����һ��������ܱ������У��������¶��·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)�����CH3OH�����ʵ�����ʱ��ı仯��ͼ1��
CH3OH(g)+H2O(g)�����CH3OH�����ʵ�����ʱ��ı仯��ͼ1��
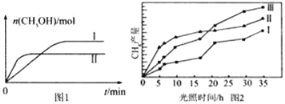
���ߢ������Ӧ��ƽ�ⳣ����С��ϵΪKI______K����������������=��������������
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�һ��ʱ���ﵽƽ�⡣
���� | �� | �� |
��Ӧ��Ͷ���� | 1mol CO2��3mol H2 | a mol CO2��b mol H2�� c mol CH3OH(g)��c molH2O(g) |
������ƽ��������ѹǿΪ��ʼ��0.8����Ҫƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���c��ȡֵ��ΧΪ____________��
��4�����ù��ܺ�������ɽ�CO2��H2(g)ת��ΪCH4��O2�����������ʱ���ڲ�ͬ���������������������£�CH4���������ʱ��ı仯��ͼ2����0~15Сʱ�ڣ�CH4��ƽ����������I����͢�Ӵ�С��˳��Ϊ_____________������ţ�
��5��һ�ּ״�ȼ�ϵ�أ�ʹ�õĵ������Һ��2mol��L-1��KOH��Һ��
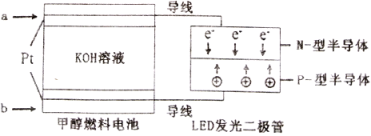
��д�����루ͨ�룩b����һ���ĵ缫��Ӧʽ________________��ÿ����6.4g�״�ת�Ƶĵ�����Ϊ_______________��
��6��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣͨ��״���£���amol/L�Ĵ�����bmol/LBa(OH)2��Һ�������Ϻ���Һ��:2c(Ba2+)=c(CH3COO-)���ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��KaΪ__________________��