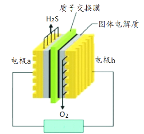
��Ŀ����
����Ŀ��(1)��ӦFe(s)��CO2(g)![]() FeO(s)��CO(g)����H1��ƽ�ⳣ��ΪK1����ӦFe(s)��H2O(g)
FeO(s)��CO(g)����H1��ƽ�ⳣ��ΪK1����ӦFe(s)��H2O(g)![]() FeO(s)��H2(g)����H2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶�ʱK1��K2��ֵ���±���
FeO(s)��H2(g)����H2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶�ʱK1��K2��ֵ���±���
700 �� | 900 �� | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
�ٷ�ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)����H��ƽ�ⳣ��ΪK������H��________(����H1����H2��ʾ)��K��________(��K1��K2��ʾ)���������������֪����ӦCO2(g)��H2(g)
CO(g)��H2O(g)����H��ƽ�ⳣ��ΪK������H��________(����H1����H2��ʾ)��K��________(��K1��K2��ʾ)���������������֪����ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)��_____________________��Ӧ(��������������������)��
CO(g)��H2O(g)��_____________________��Ӧ(��������������������)��
�����ж�CO2(g)��H2(g)![]() CO(g)��H2O(g)�ﵽ��ѧƽ��״̬��������_______(����ĸ)��
CO(g)��H2O(g)�ﵽ��ѧƽ��״̬��������_______(����ĸ)��
A��������ѹǿ���䡡�� B�����������c(CO)����
C��v��(H2)��v��(H2O) D��c(CO)��c(CO2)
(2)һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬������Ӧ��Fe(s)��CO2(g)![]() FeO(s)��CO(g)����H>0��CO2��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
FeO(s)��CO(g)����H>0��CO2��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
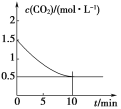
�ٸ������·�Ӧ��ƽ�ⳣ��Ϊ______��������������CO2����ʼŨ��Ϊ2.0 mol��L��1����ƽ��ʱCO2��Ũ��Ϊ______mol��L��1��
�����д�ʩ����ʹƽ��ʱ �������________(����ĸ)��
�������________(����ĸ)��
A�������¶� B������ѹǿ
C������һ������CO2 D���ټ���һ��������
���𰸡���H1����H2  ���� BC 2.0�� 0.67(��2/3) A
���� BC 2.0�� 0.67(��2/3) A
��������
��1���ٸ��ݸ�˹���ɣ������ڵ���CO2(g)��H2(g)![]() CO(g)��H2O(g)����H����H1����H2����ӦFe(s)��CO2(g)
CO(g)��H2O(g)����H����H1����H2����ӦFe(s)��CO2(g)![]() FeO(s)��CO(g)��ƽ�ⳣ��K1��c(CO)/c(CO2)����ӦFe(s)��H2O(g)
FeO(s)��CO(g)��ƽ�ⳣ��K1��c(CO)/c(CO2)����ӦFe(s)��H2O(g)![]() FeO(s)��H2(g)��ƽ�ⳣ��K2��c(H2)/c(H2O)����ӦCO2(g)��H2(g)
FeO(s)��H2(g)��ƽ�ⳣ��K2��c(H2)/c(H2O)����ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)��ƽ�ⳣ��K��c(CO)��c(H2O)/c(CO2)��c(H2)��
CO(g)��H2O(g)��ƽ�ⳣ��K��c(CO)��c(H2O)/c(CO2)��c(H2)��![]() �����ݱ������ݿ�֪���¶ȵ����ߣ�K1����K2��С������Kֵ���¶����߶�������˷�ӦCO2(g)��H2(g)
�����ݱ������ݿ�֪���¶ȵ����ߣ�K1����K2��С������Kֵ���¶����߶�������˷�ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)�����ȷ�Ӧ����A��÷�Ӧ������ѹǿΪ������ѹǿ���䲻һ��ƽ�⣬��A������B����������c(CO)���䣬һ���ﵽƽ��״̬����B��ȷ��C�v��(H2)��v��(H2O)= v��(H2)����Ϊƽ��״̬����C��ȷ��D�c(CO)��c(CO2)����˵��v����v��������˵����Ũ�Ȳ��ٷ����仯����һ��ƽ�⣬��D������
CO(g)��H2O(g)�����ȷ�Ӧ����A��÷�Ӧ������ѹǿΪ������ѹǿ���䲻һ��ƽ�⣬��A������B����������c(CO)���䣬һ���ﵽƽ��״̬����B��ȷ��C�v��(H2)��v��(H2O)= v��(H2)����Ϊƽ��״̬����C��ȷ��D�c(CO)��c(CO2)����˵��v����v��������˵����Ũ�Ȳ��ٷ����仯����һ��ƽ�⣬��D������
(2)��ͼ�����߿ɵã�ƽ��ʱ������̼��Ũ��Ϊ0.5 mol��L��1�����Ķ�����̼��Ũ��Ϊ1 mol��L��1�����ݻ�ѧ����ʽ���ﵽƽ��ʱ��c(CO)��1 mol��L��1���������·�Ӧ��ƽ�ⳣ��K��c(CO)/c(CO2)��(1 mol��L��1)/(0.5 mol��L��1)��2.0��������������CO2����ʼŨ��Ϊ2.0 mol��L��1��������ʽ���£�
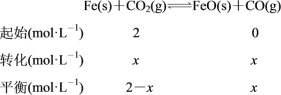
��Ϊ�¶�û��������K��2����x��(2��x)��2�����x��4/3������ƽ��ʱCO2��Ũ��Ϊ(2��4/3) mol��L��1��2/3 mol��L��1��
��A�����Ӧ���ȣ������¶ȣ�ƽ�������ƶ�����![]() ����A��ȷ��B���Ӧǰ��������䣬����ѹǿƽ�ⲻ�ƶ���
����A��ȷ��B���Ӧǰ��������䣬����ѹǿƽ�ⲻ�ƶ���![]() ���䣻��B����C��ٳ���һ������CO2������ƽ�ⳣ�����䣬��
���䣻��B����C��ٳ���һ������CO2������ƽ�ⳣ�����䣬��![]() ���䣬��C����D��ټ���һ�������ۣ�ƽ�ⲻ�ƶ���
���䣬��C����D��ټ���һ�������ۣ�ƽ�ⲻ�ƶ���![]() ���䣬��D�����������������������ѡ��ΪA��
���䣬��D�����������������������ѡ��ΪA��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ������ʵ�������Ӧ��ʵ�������ͻ���۶���ȷ����(����)
ѡ�� | ʵ����� | ʵ������ | ���ͻ���� |
A | ��Fe(NO3)2��Һ�е��������ữ��H2O2��Һ | ��Һ��Ϊ��ɫ | �����ԣ�H2O2>Fe3�� |
B | ��5mL1mol/L NaOH��Һ�еμ�5��1mol/L MgCl2��Һ��Ȼ���ٵμ�������1mol/L CuCl2��Һ | �Ȳ�����ɫ������Ȼ�������ɫ���� | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | ������NO2���ܱղ������������ˮ�� | ����ɫ���� | 2NO2(g) |
D | ��һ��������KMnO4��Һ�м����Ҷ�����HOCH2CH2OH�� | ��Һ��ɫ��ȥ | �Ҷ���������Ϊ�Ҷ��� |
A. A B. B C. C D. D
����Ŀ���ڳ��³�ѹ�¶���1 molָ�����ۼ�ʱ���յ��������±���
���ۼ�(1mol) | C��H�� | C��C�� | C��C�� | H��H�� |
���յ�����/kJ | 413.4 | 347.7 | 615 | 436 |
�������й�CH2��CH2��H2����CH3CH3��Ӧ��˵����ȷ����( )
A. ����1mol����ʱ��Ӧ�ų�����123.5kJ
B. �������������Ϊ2828.1kJ
C. �÷�ӦΪ�ӳɷ�Ӧ������ʵ����ȫת��
D. �÷�ӦΪ���ȷ�Ӧ��������ȼ���ʵ��