题目内容
【题目】在2L密闭容器中,发生3A(g)+B(g) ![]() 2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是
2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
【答案】C
【解析】
反应速率比等于系数比,A的平均反应速率为0.12mol·L﹣1·s﹣1,则B的反应速率是0.04 mol·L﹣1·s﹣1,10s内B的浓度变化是0.04 mol·L﹣1·s﹣1![]() 10s=0.4 mol·L﹣1。
10s=0.4 mol·L﹣1。
反应速率比等于系数比,A的平均反应速率为0.12mol·L﹣1·s﹣1,则B的反应速率是0.04 mol·L﹣1·s﹣1,10s内B的浓度变化是0.04 mol·L﹣1·s﹣1![]() 10s=0.4 mol·L﹣1,则10s后容器中B的物质的量是4mol-0.4 mol·L﹣1
10s=0.4 mol·L﹣1,则10s后容器中B的物质的量是4mol-0.4 mol·L﹣1![]() 2L=3.2mol,故选C。
2L=3.2mol,故选C。

【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
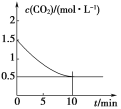
①该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
【题目】不同温度下,三个体积均为1 L的密闭容器中发生反应3H2(g)+N2(g)![]() 2NH3(g)ΔH =-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表。下列说法正确的是
2NH3(g)ΔH =-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表。下列说法正确的是
容器编号 | 温度(K) | 起始物质的量/mol | 平衡物质的量/mol | ||
H2 | N2 | NH3 | H2 | ||
Ⅰ | T1 | 3 | 1 | 0 | 2.4 |
Ⅱ | T2 | 1.2 | 0.4 | 0.2 | 1.2 |
Ⅲ | T1 | 2 | 0.2 | 0.2 | |
A. T1>T2
B. 平衡时,容器Ⅰ中反应放出的热量为92.6 kJ
C. 容器Ⅰ和容器Ⅱ中反应的化学平衡常数相同
D. 容器Ⅲ中的反应起始时向逆反应方向进行